

圖7-4
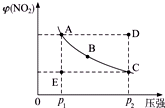
(1)A、C兩點的正反應速率的關系為vA_________vC(填“<”“>”或“=”)。
(2)A、B、C、D、正各狀態中,v(正)<v(逆)的是_________。
(3)維持p1不變,E→A所需時間為x;維持p2不變,D→C所需時間為y,則x_____________y(填“<”“>”或“=”)。
(4)欲要求使E狀態從水平方向到達C狀態后,再沿平衡曲線到達A狀態,從理論上來講,可選用的方法是____________。
A.從p1無限緩慢加壓至p2,再由p2無限緩慢降壓至p1
B.從p1突然加壓至p2,再由p2無限緩慢降壓至p1
C.從p1突然加壓至p2,再由p2突然降壓至p1
D.從p1無限緩慢加壓至p2,再由p2突然降壓至p1
(1)< (2)D (3)> (4)B
提示:(1)由于C點對應的壓強大于A點的壓強,所以正反應速率vA<vC。
(2)A、B、C三點都在平衡線上,所以此三點的正逆反應速率相等。D點要達到平衡,必須降低NO2的百分含量,也就是使平衡向逆反應方向移動,從而得出v(正)<v(逆)。E點要達到平衡,必須提高NO2的質量分數,也就是使平衡向正反應方向移動,從而得出v(正)>v(逆)。故答案為D。
(3)AE與DC線段的長度相等,也就是NO2的體積變化量相等。但由于D點的壓強大于正點的壓強,所以D點的反應速率大于正點的反應速率,故所需時間x>y。
(4)對于壓強的改變,當快速加壓時,平衡未移動,但壓強迅速增大,反映在圖像上就是縱坐標不變,橫坐標不斷增大;當緩慢加壓時,平衡不斷地被破壞,但又不斷地建立新的平衡,所以緩慢加壓時,NO2的體積分數的變化應不斷地在平衡曲線上滑動。所以“使E狀態從水平方向到達C狀態”,應突然加壓;“由C沿平衡曲線以達A狀態”,應緩慢降壓。答案為B。


科目:高中化學 來源: 題型:
 對于N2O4(g)
對于N2O4(g) 2NO2(g)在溫度一定時,平衡體系中NO2的體積分數φ(NO2)隨壓強的變化情況如圖所示(實線上的任何一點為對應壓強下的平衡點).
2NO2(g)在溫度一定時,平衡體系中NO2的體積分數φ(NO2)隨壓強的變化情況如圖所示(實線上的任何一點為對應壓強下的平衡點).查看答案和解析>>
科目:高中化學 來源:新課程同步學案專家伴讀 化學選修4(化學反應原理) 魯科版 魯科版 題型:022
對于N2O4(g)![]() 2NO2(g),反應達平衡后,K為平衡常數,保持溫度不變.
2NO2(g),反應達平衡后,K為平衡常數,保持溫度不變.
(1)壓強增大,體積________,濃度________.K變嗎?________;Q變嗎?________.由于Δv>0,所以Q________K,平衡向________移動.
(2)壓強減小,體積________,濃度________.K變嗎?________;Q變嗎?________.由于Δv>0,所以Q________K,平衡向________移動.
查看答案和解析>>
科目:高中化學 來源: 題型:
(1)A、C兩點的正反應速率的關系為A____________(填“<”“>”或“=”)C。
(2)A、B、C、D、E各狀態中,v(正)<v(逆)的是____________________。
(3)維持p1不變,E→A所需時間為x;維持p2不變,D→C所需時間為y,則x________y (填“<”“>”或“=”)。
(4)欲要求使E狀態從水平方向到達C狀態后,再沿平衡曲線以達A狀態,從理論上來講,可選用的條件是____________________。
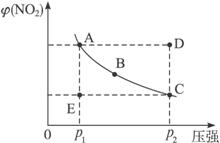
A.從p1無限緩慢加壓至p2,再由p2無限緩慢降壓至p1
B.從p1突然加壓至p2,再由p2無限緩慢降壓至p1
C.從p1突然加壓至p2,再由p2突然降壓至p1
D.從p1無限緩慢加壓至p2,再由p2突然降壓至p1
查看答案和解析>>
科目:高中化學 來源:2011-2012學年上海市閔行區高三上學期期末質量抽測化學試卷 題型:填空題
下圖是煤化工產業鏈的一部分,試運用所學知識,解決下列問題:

(1)已知該產業鏈中某反應的平衡表達式為:K=
它所對應反應的化學方程式為 。
已知在一定溫度下,在同一平衡體系中各反應的平衡常數如下:
C(s)+CO2(g)  2CO(g),K1
2CO(g),K1
CO(g)+H2O(g)  H2(g)+CO2(g),K2
H2(g)+CO2(g),K2
C(s)+H2O(g)  CO(g)+H2(g),K3
CO(g)+H2(g),K3
則K1、K2、K3之間的關系為 。
(2)煤化工通常通過研究不同溫度下平衡常數以解決各種實際問題。已知等體積的一氧化碳和水蒸氣進入反應器時,發生如下反應:CO(g)+H2O(g) H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
|
溫度/℃ |
400 |
500 |
800 |
|
平衡常數K |
9.94 |
9 |
1 |
該反應的逆反應方向是 反應(填“吸熱”或“放熱”),若在500℃時進行,設起始時CO和H2O的起始濃度均為0.020mol/L,在該條件下,反應達到平衡時CO的轉化率為 。
(3)對于反應N2O4(g) 2NO2(g)-Q(Q>0),在溫度
2NO2(g)-Q(Q>0),在溫度
為T1、T2時,平衡體系中NO2的體積分數隨壓強變化
曲線如圖所示。下列說法正確的是 。

A.兩種不同的溫度比較:T1 > T2
B.A、C兩點的反應速率:A<C
C.B、C兩點的氣體的平均相對分子質量:B<C
D.由狀態B到狀態A,可以用加熱的方法實現
(4)如右圖,采用NH3作還原劑,煙氣以一定的流速通過兩種不同催化劑,測量逸出氣體中氮氧化物含量,從而確定煙氣脫氮率,反應原理為:NO(g) + NO2(g) + 2NH3(g)  2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)

以下說法正確的是(注:脫氮率即氮氧化物轉化率)
A.上述反應的正反應為吸熱反應
B.相同條件下,改變壓強對脫氮率沒有影響
C.曲線①、②最高點表示此時平衡轉化率最高
D.催化劑①、②分別適合于250℃和450℃左右脫氮
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com