
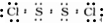 .
. .
. 分析 A、B、C、D、E四種短周期元素,原子序數依次增大,A原子的電子層數與它的核外電子總數相同,則A為H元素;
B元素的氫化物與E元素的氫化物反應只生成一種鹽且B原子序數小于E,則B為N元素;
C、D位于同一族,它們能組成DC2、DC3兩種常見化合物,則C是O、D是S元素,E原子序數大于D且為短周期元素,能形成氫化物,所以E是Cl元素;
(1)根據推斷確定這幾種元素名稱;
(2)由H、N、O中的兩種元素組成,且與H2O分子具有相同電子數的兩種陽離子是銨根離子和水和氫離子;
(3)S與Cl可形成共價化合物S2Cl2,分子中S與Cl均滿足8電子穩定結構,則S元素形成兩個共價鍵、Cl元素形成一個共價鍵;
(4)H、N、O可以形成一種鹽,此鹽中H、N、O元素的原子的個數比為4:2:3,該鹽為硝酸銨,該鹽受熱可產生氮氣和硝酸,同時還生成水,根據反應物和生成物及反應條件書寫方程式;
(5)H、N可以形成一種離子化合物為氫化銨.
解答 解:A、B、C、D、E四種短周期元素,原子序數依次增大,A原子的電子層數與它的核外電子總數相同,則A為H元素;
B元素的氫化物與E元素的氫化物反應只生成一種鹽且B原子序數小于E,則B為N元素;
C、D位于同一族,它們能組成DC2、DC3兩種常見化合物,則C是O、D是S元素,E原子序數大于D且為短周期元素,能形成氫化物,所以E是Cl元素;
(1)C、D、E分別是氧、硫、氯元素,故答案為:氧;硫;氯;
(2)由H、N、O中的兩種元素組成,且與H2O分子具有相同電子數的兩種陽離子是銨根離子和水和氫離子,化學式分別為NH4+、H3O+,故答案為:NH4+;H3O+;
(3)S與Cl可形成共價化合物S2Cl2,分子中S與Cl均滿足8電子穩定結構,則S元素形成兩個共價鍵、Cl元素形成一個共價鍵,則S2Cl2電子式為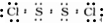 ,故答案為:
,故答案為: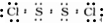 ;
;
(4)H、N、O可以形成一種鹽,此鹽中H、N、O元素的原子的個數比為4:2:3,該鹽為硝酸銨,化學式為NH4NO3,該鹽受熱可產生氮氣和硝酸,同時還生成水,根據反應物和生成物及反應條件書寫方程式為5NH4NO3═4N2↑+2HNO3+9H2O,
故答案為:NH4NO3;5NH4NO3═4N2↑+2HNO3+9H2O;
(5)H、N可以形成一種離子化合物為氫化銨,其電子式為 ,故答案為:
,故答案為: .
.
點評 本題考查位置結構性質的相互關系及應用,涉及電子式的書寫、化學式的書寫,正確推斷元素、明確物質結構即可解答,注意氫化銨電子式的書寫方法,知道該化合物中H元素化合價為+1價、-1價.


科目:高中化學 來源: 題型:選擇題
| A. | H2→H+H | B. | H+Cl→HCl | ||
| C. | H2O(l)→H2O(g) | D. | CaCO3$\stackrel{高溫}{→}$CaO+CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 正極反應為Ag-e-=Ag+ | |
| B. | 放電時,交換膜右側溶液中有大量白色沉淀生成 | |
| C. | 當電路中轉移0.1mol e-,通過交換膜的陽離子為0.2mol | |
| D. | 用KCl溶液代替鹽酸,則電池總反應不改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④ | B. | ①⑤ | C. | ①③④⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | IA族元素的金屬性比IIA族元素的金屬性強 | |
| B. | 第三周期元素的離子半徑從左到右逐漸減小 | |
| C. | 同周期非金屬氧化物對應的水化物的酸性從左到右依次增加 | |
| D. | VIA族元素的氫化物中,穩定性最好的其沸點也最高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 弱酸 | H2CO3 | H2SO3 | HClO |
| 電離平衡常數 (25℃) | K1=4.30×10-7 | K1=1.54×10-2 | K=2.95×10-8 |
| K2=5.61×10-11 | K2=1.02×10-7 |
| A. | 相同溫度時三種溶液的pH關系:Na2CO3>NaClO>Na2SO3 | |
| B. | ClO-+H2O+CO2→HClO+HCO3- | |
| C. | 2ClO-+SO2+H2O→2HClO+SO32- | |
| D. | 等體積、等物質的量濃度的HClO和Na2CO3混合后溶液呈中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
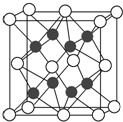 化合物Na2O的晶胞如圖.
化合物Na2O的晶胞如圖.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鎂、NaOH溶液 | B. | 銅、稀硫酸 | C. | 鋅、濃硝酸 | D. | 鐵、FeCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;
;查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com