
| A. | 1molOH-的質量為17g•mol-1 | |
| B. | 0.5mol H2所占體積約為11.2L | |
| C. | 等質量的金剛石和晶體硅所含原子個數之比為7:3 | |
| D. | 1mol NaCl固體溶于0.5L水中,所得溶液的物質的量濃度為2mol•L-1 |
分析 A.氫氧根離子的摩爾質量為17g/mol,質量的單位為g;
B.沒有指出標準狀況下,無法計算氫氣的體積;
C.金剛石的主要成分為C,根據n=$\frac{m}{M}$計算等質量的二者的物質的量,然后可計算出含有原子數之比;
D.所得溶液的體積不是0.5L,溶液濃度不是2mol/L.
解答 解:A.1mol氫氧根離子的質量為:17g/mol×1mol=17g,故A錯誤;
B.不是標準狀況下,不能使用標準狀況下的氣體摩爾體積計算,故B錯誤;
C.根據n=$\frac{m}{M}$可知,質量相等時,二者物質的量之比與摩爾質量成反比,則金剛石中C原子與硅原子的物質的量之比與摩爾質量成反比,二者物質的量之比=28g/mol:12g/mol=7:3,則二者含有原子的數目之比=原子的物質的量之比=7:3,故C正確;
D.1mol NaCl固體溶于0.5L水中,所得溶液的體積不是0.5L,無法計算溶液濃度,故D錯誤;
故選C.
點評 本題考查了物質的量的計算,題目難度不大,明確標準狀況下氣體摩爾體積的使用條件為解答關鍵,注意掌握物質的量與摩爾質量、物質的量濃度、氣體摩爾體積、阿伏伽德羅常數等之間的關系,試題有利于提高學生的化學計算能力.


科目:高中化學 來源: 題型:選擇題
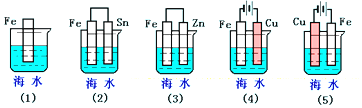
| A. | (5)(2)(1)(3)(4) | B. | (2)(5)(3)(4)(1) | C. | (5)(3)(4)(1)(2) | D. | (1)(5)(3)(4)(2) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶于水能導電,屬于電解質 | |
| B. | 使品紅溶液褪色,有漂白性 | |
| C. | 使酸性高錳酸鉀溶液褪色,有還原性 | |
| D. | 能殺菌、消毒,可按照國家標準用作食物的防腐劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
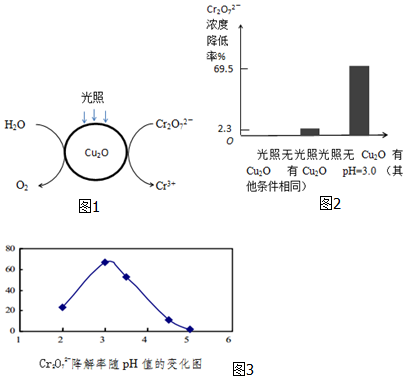
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放電時PbO2發生氧化反應 | |
| B. | 充電時電解質溶液的質量減少 | |
| C. | 放電時的負極反應式為Pb+SO42--2e-=PbSO4 | |
| D. | 充電時的陰極反應式為PbSO4+2H2O-2e-=PbO2+SO42-+4H+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應中Ag和H2S均是還原劑,發生氧化反應 | |
| B. | 銀針驗毒時,空氣中的氧氣失去電子 | |
| C. | X的化學式為Ag2S,顏色為黑色,通過觀察銀針顏色變化來判斷死者是否中毒 | |
| D. | 每生成1mo1X,反應轉移4mo1 e- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 編號 | 實驗內容 | 實驗目的 |
| A | 向含有酚酞的Na2CO3溶液中加入少量BaC12固體,溶液紅色變淺 | 證明Na2CO3溶液中存在水解平衡 |
| B | 室溫下,用pH試紙分別測定濃度為18mol/L和0.1mol/L H2SO4溶液的pH | 比較不同濃度H2SO4的酸性強弱 |
| C | 配制FeCl2溶液時,先將FeCl2溶于適量濃鹽酸中,再用蒸餾水稀釋到所需濃度,最后在試劑瓶中加入少量銅粉 | 抑制Fe2+水解,并防止Fe2+被氧化 |
| D | 向10mL 0.2mol/L NaOH溶液中滴入2滴0.1mol/LMgCl2溶液,產生白色沉淀后,再滴加2滴0.1mol/LFeCl3溶液,又生成紅褐色沉淀 | 證明在相同溫度下的Ksp>Ksp |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
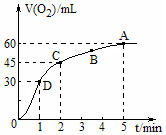 在50mL過氧化氫溶液中加入1g MnO2粉末,標準狀況下放出氣體的體積和時間的關系如圖所示,下列說法不正確的是( )
在50mL過氧化氫溶液中加入1g MnO2粉末,標準狀況下放出氣體的體積和時間的關系如圖所示,下列說法不正確的是( )| A. | 標準狀況下,實驗放出一半氣體所需的時間為1min | |
| B. | A、B、C、D各點反應速率中A點最慢,D點快 | |
| C. | 0~2min內產生O2的平均反應速率為22.5mL•min-1 | |
| D. | 本實驗中影響反應速率的因素只有催化劑和H2O2的濃度 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com