
分析 ①甲中堿石灰吸收水和二氧化碳,CO還原CuO得到二氧化碳,但不能根據堿石灰增加的質量計算出C、H原子個數比;乙中濃硫酸吸收的是水、堿石灰吸收的是二氧化碳,最終CO燃燒生成二氧化碳,可以根據二者計算H、C原子個數比;
②濃硫酸吸收水的物質的量=$\frac{5.04g}{18g/mol}$=0.28mol,堿石灰吸收二氧化碳的物質的量=$\frac{2.64g}{44g/mol}$=0.06mol,CO燃燒生成二氧化碳物質的量=$\frac{3.52g}{44g/mol}$=0.08mol,根據質量守恒定律可確定該有機物分子中含有的O原子的質量、物質的量,從而可確定其最簡式;
③根據C、H原子個數比及狀態判斷物質;C、H原子個數被1:4,每個C原子最多形成4個C-H鍵.
解答 解:①甲中堿石灰吸收水和二氧化碳,剩余的CO還原CuO得到二氧化碳,但不能根據堿石灰增加的質量計算出C、H原子個數比,所以乙不能確定該物質的最簡式;
則甲可以求出A的最簡式、乙不能求出A的最簡式;
乙中濃硫酸吸收的是水、堿石灰吸收的是二氧化碳,最終CO燃燒生成二氧化碳,可以根據水的物質的量、二氧化碳的物質的量計算H、C原子個數比,從而確定該物質化學式,
根據分析可知,能夠確定A的最簡式的為乙,
故答案為:乙;
②濃硫酸吸收水的物質的量=$\frac{5.04g}{18g/mol}$=0.28mol,堿石灰吸收二氧化碳的物質的量=$\frac{2.64g}{44g/mol}$=0.06mol,CO燃燒生成二氧化碳物質的量=$\frac{3.52g}{44g/mol}$=0.08mol,
該有機物分子中含有C、H原子的總質量為:1g/mol×0.28mol×2+12g/mol×(0.06+0.08)mol=2.24g<4.48g,說明該有機物分子中含有氧元素,含有氧原子的物質的量為:$\frac{4.48g-2.24g}{16g/mol}$=0.14mol,所以該有機物分子中C、H、O原子數之比為:0.14mol:0.056mol:0.14mol=1:4:1,該有機物最簡式為:CH4O,
故答案為:CH4O;
③其最簡式為CH4O,C、H原子個數被1:4,每個C原子最多形成4個C-H鍵,最簡式中,H的含量已經達到最大值,所以不用測定其它數據,
故答案為:否.
點評 本題考查了有機物分子式的確定,題目難度中等,正確分析實驗方案為解答關鍵,注意掌握守恒思想在確定有機物分子式中的應用方法,試題培養了學生的分析能力及化學計算能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
| A. | 反應A(g)?2B(g)△H,若正反應的活化能為Ea kJ•mol-1,逆反應的活化能為Eb kJ•mol-1,則△H=-(Ea-Eb)kJ•mol-1 | |
| B. | 某溫度下,氯化鈉在水中的溶解度是20g,則該溫度下的飽和氯化鈉溶液溶質的質量分數為20% | |
| C. | 將濃度為0.1 mol•L-1HF溶液加水不斷稀釋過程中,電離平衡常數Ka(HF)保持不變,$\frac{{c({F^-})}}{{c({H^+})}}$始終保持增大 | |
| D. | 將0.2 mol•L-1的CH3COOH溶液與0.1 mol•L-1的NaOH溶液等體積混合后,溶液中有關粒子的濃度滿足下列關系:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
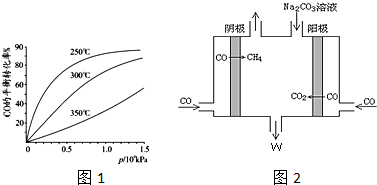
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用A裝置,若A為濃醋酸、B為碳酸鈉(粉狀)、C為苯酚鈉溶液,一定能驗證醋酸、碳酸、苯酚酸性的強弱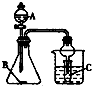 | |
| B. | 利用B裝置可以完成乙酸乙酯制取實驗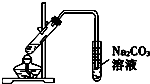 | |
| C. | 利用C裝置可以完成石油蒸餾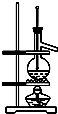 | |
| D. | 利用D裝置可以完成實驗室制乙烯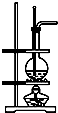 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
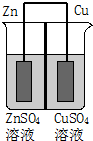 如圖為一原電池示意圖,在原電池兩極之間設有隔膜,離子可以自由通過.則下列說法不正確的是( )
如圖為一原電池示意圖,在原電池兩極之間設有隔膜,離子可以自由通過.則下列說法不正確的是( )| A. | Zn2+通過隔膜從負極區向正極區移動 | |
| B. | 電子由Cu極通過導線流向Zn極 | |
| C. | 一段時間后ZnSO4溶液濃度增大CuSO4溶液濃度減小 | |
| D. | Cu2+與Zn2+物質的量之和保持不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子半徑:Q>W>Z | |
| B. | Q的氫化物的水溶液一定具有強酸性 | |
| C. | X、Y、Q可同時存在同一離子化合物中 | |
| D. | 單質的沸點:W>Q>Z |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com