
| 物質 | 熔點/℃ | 沸點/℃ | 化學性質 |
| Sn | 231 | 227 | 加熱時與Cl2反應生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 極易水解 |
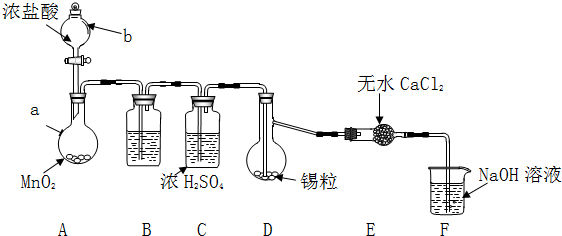
分析 Ⅱ.SnCl4極易水解,反應應在無水環境下進行進行,A中發生反應:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于鹽酸易揮發,制備的氯氣中含有HCl及水蒸氣,B中盛放飽和食鹽水除去HCl,可以降低氯氣的溶解,C中濃硫酸吸收水蒸氣,干燥氯氣,氯氣與Sn在D反應生成SnCl4,未反應的氯氣,用氫氧化鈉溶液稀釋,防止污染空氣,干燥管中氯化鈣吸收水蒸氣,防止加入D中使產物水解.
(1)儀器b為分液漏斗;
(2)整個裝置中充分氯氣時,再加熱熔化錫粒合成SnCl4;
(3)裝置A中未反應完的MnO2與溶液不互溶,通過過濾進行分離回收;
Ⅲ.(1)F中氯氣與氫氧化鈉反應生成氯化鈉、次氯酸鈉與水;
(2)SnCl4沸點低,在C得到主要為SnCl4蒸汽,應在D、E之間添加冷卻收集裝置進行收集;
(3)由于Sn2+易被Fe3+、O2等氧化,可以加入適量稀HCl和KSCN溶液,再滴入幾滴FeCl3溶液,根據顏色變化判斷.
解答 解:Ⅱ.SnCl4極易水解,反應應在無水環境下進行進行,A中發生反應:MnO2+4HCl(濃) $\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,由于鹽酸易揮發,制備的氯氣中含有HCl及水蒸氣,B中盛放飽和食鹽水除去HCl,可以降低氯氣的溶解,C中濃硫酸吸收水蒸氣,干燥氯氣,氯氣與Sn在D反應生成SnCl4,未反應的氯氣,用氫氧化鈉溶液稀釋,防止污染空氣,干燥管中氯化鈣吸收水蒸氣,防止進入D中使產物水解.
(1)由儀器結構特征,可知儀器b為分液漏斗;由上述分析可知,無水CaCl2的作用是:吸收水蒸氣,防止進入D中使SnCl4水解,B中的試劑是飽和NaCl溶液,
故答案為:分液漏斗;吸收水蒸氣,防止進入D中使SnCl4水解;C;
(2)整個裝置中充分氯氣時,即充滿黃綠色氣體,再加熱熔化錫粒合成SnCl4,
故答案為:充滿黃綠色氣體;
(3)裝置A中未反應完的MnO2與溶液不互溶,經過過濾、洗滌、干燥進行分離回收,
故答案為:過濾;
Ⅲ.(1)F中氯氣與氫氧化鈉反應生成氯化鈉、次氯酸鈉與水,反應離子方程式為:2OH-+Cl2=Cl-+ClO-+H2O,
故答案為:2OH-+Cl2=Cl-+ClO-+H2O;
(2)SnCl4沸點低,在C中得到主要為SnCl4蒸汽,應在D、E之間添加連有冷凝管的集氣瓶,通入冷凝水冷卻收集,
故答案為:連有冷凝管的集氣瓶;
(3)由于Sn2+易被Fe3+、O2等氧化,加入適量稀HCl和KSCN溶液,再滴入幾滴FeCl3溶液,不出現紅色,則含有SnCl2,否則無SnCl2,
故答案為:適量稀HCl和KSCN溶液,再滴入幾滴FeCl3溶液.
點評 本題考查制備實驗方案設計、對原理與裝置的分析評價、物質檢驗方案設計等,注意閱讀題目獲取信息并遷移運用,難度中等.


科目:高中化學 來源: 題型:解答題
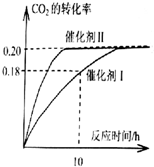 已知CO2可以生產綠色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃時的恒容密閉容器中,當c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1
已知CO2可以生產綠色燃料甲醇.CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-187.4kJ/mol.300℃時的恒容密閉容器中,當c(CO2)=1.00mol.L-1、c(H2)=1.60mol.L-1查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③ | B. | ①②③④ | C. | ①②③④⑤ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 2.4 g 金屬鎂變成鎂離子時失去的電子數為 0.2 NA | |
| B. | 標準狀況下,18 g H2O中含有NA個水分子 | |
| C. | 常溫常壓下,11.2 L H2和O2的混合物所含分子個數是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+數目是NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
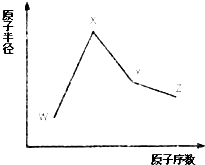 W、X、Y和Z是常見的短周期元素,其原子半徑隨原子序數變化如圖所示.己知W的一種核素的質量數為18,中子數為10;X和Ne的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的原子半徑在同周期主族元素中最小.
W、X、Y和Z是常見的短周期元素,其原子半徑隨原子序數變化如圖所示.己知W的一種核素的質量數為18,中子數為10;X和Ne的核外電子數相差1;Y的單質是一種常見的半導體材料;Z的原子半徑在同周期主族元素中最小.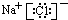 ;
;查看答案和解析>>
科目:高中化學 來源: 題型:解答題
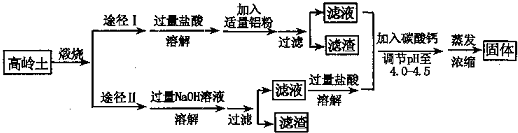
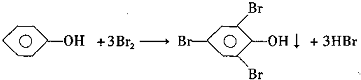
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com