
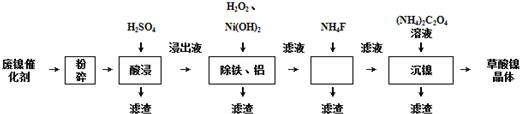
| 金屬離子 | 開始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Al3+ | 3.0 | 5.0 |
| Ni2+ | 6.7 | 9.5 |

分析 廢鎳催化劑(成分為Al2O3、Ni、Fe、SiO2、CaO等),用硫酸溶解,SiO2不與硫酸反應,過濾得到濾液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及過量的硫酸,加入H2O2將Fe2+氧化為Fe3+,加入Ni(HO)2調節pH,使pH大于5.0小于6.8,Fe3+轉化為Fe(OH)3沉淀、Al3+轉化為Al(OH)3沉淀,過濾除去,濾液中含有NiSO4、CaSO4,向濾液中加入NH4F,除去Ca 2+,過濾,再向濾液中加入(NH4)2C2O4,得到草酸鎳沉淀,再過濾、洗滌、干燥得草酸鎳晶體,
(1)把廢鎳催化劑粉碎,增大了反應的接觸面積,加快反應速率,提高鎳的浸出率;
(2)根據鎳浸出率隨時間變化圖可知,70℃時,鎳浸出率很大,從時間看,120min鎳浸出率就已經很高了;
(3)“沉鎳”工序中,可以用繼續滴加(NH4)2C2O4溶液的方法,檢驗Ni2+是否沉淀完全,待溶液靜置后,在上層清液中繼續滴加(NH4)2C2O4溶液,若不產生沉淀,則Ni2+已經沉淀完全;“沉鎳”工序生成了(NH4)2SO4,用乙醇洗滌,能洗去(NH4)2SO4雜質、便于烘干;
(4)為了除去鐵、鋁元素,取“浸出液”,用雙氧水氧化二價鐵為三價鐵,再加入NaOH溶液,調節溶液5.0≤pH≤6.7,讓Al3+、Fe3+沉淀完全,不能讓Ni2+沉淀;根據Ksp(CaF2)=1.46×10-10<Ksp(CaC2O4)=2.34×10-9,加入適量NH4F溶液,生成CaF2,除去Ca2+;
(5)草酸鎳晶體(NiC2O4•2H2O)在320℃分解得到Ni、CO2和H2O.
解答 解:(1)把廢鎳催化劑粉碎,增大了反應的接觸面積,加快反應速率,提高鎳的浸出率,
故答案為:增大接觸面積,加快反應速率,提高鎳的浸出率;
(2)根據鎳浸出率隨時間變化圖可知,70℃時,鎳浸出率很大,從時間看,120min鎳浸出率就已經很高了,
故答案為:c;
(3)“沉鎳”工序中,可以用繼續滴加(NH4)2C2O4溶液的方法,檢驗Ni2+是否沉淀完全,待溶液靜置后,在上層清液中繼續滴加(NH4)2C2O4溶液,若不產生沉淀,則Ni2+已經沉淀完全;“沉鎳”工序生成了(NH4)2SO4,用乙醇洗滌,能洗去(NH4)2SO4雜質、便于烘干、減少草酸鎳晶體損失,
故答案為:靜置,在上層清液中繼續滴加(NH4)2C2O4溶液,若不產生沉淀,則Ni2+已經沉淀完全;洗去(NH4)2SO4雜質、便于烘干、減少草酸鎳晶體損失;
(4)為了除去鐵、鋁元素,用雙氧水氧化二價鐵為三價鐵,再加入NaOH溶液,調節溶液5.0≤pH≤6.7,讓Al3+、Fe3+沉淀完全,不能讓Ni2+沉淀;根據Ksp(CaF2)=1.46×10-10<Ksp(CaC2O4)=2.34×10-9,加入適量NH4F溶液,生成CaF2,除去Ca2+,
故答案為:5.0≤pH<6.7;除去雜質Ca2+;
(5)草酸鎳晶體(NiC2O4•2H2O)在320℃分解得到Ni、CO2和H2O,反應的方程式為NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O;
故答案為:NiC2O4•2H2O$\frac{\underline{\;320℃\;}}{\;}$Ni+2CO2↑+2H2O.
點評 本題考查了物質分離的實驗設計和方法應用,主要是利用溶液不同pH條件下離子沉淀的情況不同,控制溶液PH除去雜質離子,得到較純凈的硫酸鎳溶液來制備硫酸鎳晶體,同時考查了除雜原則不能引入新的雜質,題目難度大


科目:高中化學 來源: 題型:實驗題
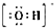 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Zn 為正極,Ag2O 為負極 | |
| B. | 電解質溶液中,OH-移向 Ag2O 極 | |
| C. | 鋅發生還原反應,氧化銀發生氧化反應 | |
| D. | 原電池工作時,正極區溶液 pH 值增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ”分別表示不同元素的原子.下列各項中對圖示模型理解正確的是( )
”分別表示不同元素的原子.下列各項中對圖示模型理解正確的是( )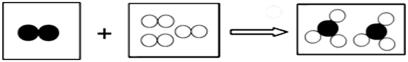
| A. | 該反應屬于分解反應 | |
| B. | 反應中共有兩種元素參與 | |
| C. | 反應物和生成物中只有一種單質 | |
| D. | 參加反應的兩種物質分子個數之比為2:3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 ②白磷 ③2,3-二甲基丁烷 ④
②白磷 ③2,3-二甲基丁烷 ④

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
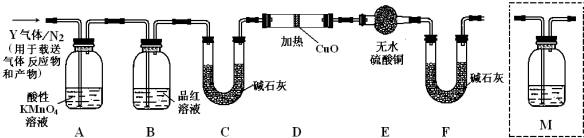
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素核外電子總傾向先排滿能量較高的電子層,排滿后排至能量較低的電子層? | |
| B. | 最外層電子數為1的元素一定是金屬元素 | |
| C. | 原子核外M層最多容納18個電子 | |
| D. | 鎂原子與鎂離子具有相同的電子層數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 誤將潔廁靈與消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O | |
| B. | 玻璃試劑瓶被燒堿溶液腐蝕:SiO2+2Na++2OH-═Na2SiO3↓+H2O | |
| C. | 硝酸鋁溶液中加入過量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 向NaHCO3溶液中加入過量的澄清石灰水,出現白色沉淀:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com