
 ;
; .
. 分析 X、Y、Z、W四種元素分別是元素周期表中連續三個短周期的元素,且原子序數依次增大,則X為H元素;Z原子最外層電子數是次外層電子數的3倍,原子只能有2個電子層,最外層電子數為6,則Z為O元素;Y、Z為同周期的相鄰元素,則Y為N元素,Y與X形成的NH3分子中有3個共價鍵;X、W同主族,則W原子的質子數等于Y、Z原子最外層電子數之和,則W為Na,據此解答.
解答 解:X、Y、Z、W四種元素分別是元素周期表中連續三個短周期的元素,且原子序數依次增大,則X為H元素;Z原子最外層電子數是次外層電子數的3倍,原子只能有2個電子層,最外層電子數為6,則Z為O元素;Y、Z為同周期的相鄰元素,則Y為N元素,Y與X形成的NH3分子中有3個共價鍵;X、W同主族,則W原子的質子數等于Y、Z原子最外層電子數之和,則W為Na.
(1)由上述元素中,組成4核10電子的離子為H3O+,電子式為 ,
,
故答案為: ;
;
(2)H與O可分別形成10電子和18電子的分子,為H2O2、H2O,過氧化氫在二氧化錳作催化劑條件下分解為水與氧氣,反應方程式為:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,
故答案為:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑;
(3)由X、Y、Z所形成的常見離子化合物是NH4NO3,W的最高氧化物的水化物為NaOH,二者反應的離子方程式為:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O,X與W形成的化合物是NaH,氫化鈉和水反應生成氫氧化鈉和氫氣,反應離子方程式為:NaH+H2O=Na++OH-+H2↑,該反應中水得電子作氧化劑,
故答案為:NH4NO3;NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O;NaH+H2O=Na++OH-+H2↑;氧化劑;
(4)用電子式表示W與Z形成Na2O化合物的過程: ,
,
故答案為: .
.
點評 本題考查結構性質位置關系,推斷元素是解題關鍵,側重對化學用語的考查,熟練掌握元素化合物性質,(3)中根據水解原理NaH與水的反應,中學基本不涉及金屬氫化物,掌握用電子式表示化學鍵或物質的形成.


科目:高中化學 來源: 題型:選擇題

| A. | 點①所示溶液中:2c(CH3COO-)-2c(CH3COOH)=c(H+)-c(OH-) | |
| B. | 點②所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | 點③所示溶液中:c(CH3COO-)-c(CH3COOH)=c(Na+)+2c(H+)-2c(OH-) | |
| D. | pH=12的溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)>c(CH3COOH) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素周期表中第16個縱行表示為ⅥA | |
| B. | ⅦA元素也稱為鹵族元素 | |
| C. | 元素周期表中,Ⅷ包括第8,9,10縱行 | |
| D. | 0族元素的原子最外層電子數為8,元素化合價為0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NH4Cl、HCl、H2O、H2 | B. | Cl2、Na2S、HCl、SO2 | ||
| C. | HBr、CO2、NH3、CS2 | D. | Na2O2、H2O2、H2O、O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
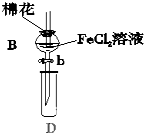 某探究學習小組用如圖所示裝置進行SO2、Fe2+和Cl-還原性強弱比較實驗,實驗過程如下:
某探究學習小組用如圖所示裝置進行SO2、Fe2+和Cl-還原性強弱比較實驗,實驗過程如下:| 過程Ⅱ中檢出離子 | 過程Ⅳ中檢出離子 | |
| 甲 | 有Fe3+無Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+無Fe2+ | 有Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ②③④ | C. | ②③④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com