
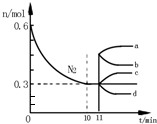
 研究氮機器化合物對化工生產有重要意義.
研究氮機器化合物對化工生產有重要意義.| T/℃ | T1 | T2 | T3 |
| K | 10 | 2.5 | 1.8 |
分析 (1)根據v=$\frac{△c}{△t}$計算v(N2),再利用反應速率之比等于其化學計量數之比計算v(H2);
11min壓縮體積,瞬間各組分的物質的量不變,而壓強增大,平衡向正反應移動,平衡時氮氣的物質的量小于原平衡;
(2)正反應為放熱反應,升高溫度,平衡向逆反應方向移動,平衡常數減小,據此判斷溫度高低,溫度越低,反應速率越慢,到達平衡時間越長;
(3)根據平衡常數計算平衡時氮氣的濃度,若要使平衡建立過程中NH3的濃度逐漸減小,即平衡向逆反應分析進行,則氮氣的濃度應小于平衡濃度.
解答 解:(1)由圖2可知,0~10min內氮氣的物質的量變化量為0.6mol-0.3mol=0.3mol,v(N2)=$\frac{\frac{0.3mol}{2L}}{10min}$=0.015mol/(L•min),由于反應速率之比等于化學計量數之比,故v(H2)=3v(N2)=3×0.015mol/(L•min)=0.045mol/(L•min);
11min壓縮體積,瞬間各組分的物質的量不變,壓強增大,平衡向正反應移動,平衡時氮氣的物質的量小于原平衡,故n(N2)的變化曲線為d,
故答案為:0.045;d;
(2)正反應為放熱反應,升高溫度,平衡向逆反應方向移動,平衡常數減小,故溫度T1<T2<T3,溫度越低,反應速率越慢,到達平衡時間越長,即溫度T1達到平衡時間最長,
故答案為:T1;
(3)若處于平衡時,由平衡常數可知:$\frac{0.{1}^{2}}{x×0.{1}^{3}}$=10,解得x=1,若要使平衡建立過程中NH3的濃度逐漸減小,即平衡向逆反應分析進行,則氮氣的濃度應小于1mol/L,即0≤x<1,
故答案為:0≤x<1.
點評 本題考查物質的量隨時間變化曲線、化學反應速率計算、外界條件對平衡移動影響、平衡常數影響因素及應用,題目難度中等,注重對常考知識點的考查,能較好的體現學生分析解答問題的能力.


科目:高中化學 來源: 題型:選擇題
| A. | 0.4mol•L-1 | B. | 0.3mol•L-1 | C. | 0.2mol•L-1 | D. | 0.1mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 烷烴的沸點隨碳原子數增加而逐漸升高 | |
| B. | 任何烷烴分子中碳氫原子個數比都是相同的 | |
| C. | 丙烷與Cl2發生取代反應后生成的一氯代物不只是一種 | |
| D. | 正丁烷的熔點、沸點比異丁烷的高 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 中國最新戰機殲-31使用了高強度、耐高溫的鈦合金材料.工業上冶煉鈦的反應如下:TiCl4+2Mg=Ti+2MgCl2.下列有關該反應的說法正確的是( )
中國最新戰機殲-31使用了高強度、耐高溫的鈦合金材料.工業上冶煉鈦的反應如下:TiCl4+2Mg=Ti+2MgCl2.下列有關該反應的說法正確的是( )| A. | TiCl4是還原劑 | |
| B. | 每消耗1mol Mg,Mg得到2mol電子 | |
| C. | TiCl4發生氧化反應 | |
| D. | 為防止Mg、Ti被氧化該反應可在氬氣流中進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
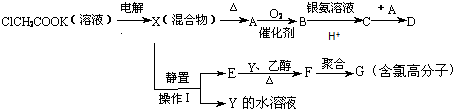
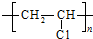 .
. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 容器 | 甲 | 乙 |
| 反應物投入量 | 1molCO2(g)和3molH2(g) | 1molCH3OH和1molH2O(g) |
| 平衡時c(CH3OH) | c1 | c2 |
| 平衡時能量變化 | 放出29.4kJ | 吸收akJ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 酸性 HClO4>HBrO4>HIO4 | B. | 堿性 Ba(OH)2>Ca(OH)2>Mg(OH)2 | ||
| C. | 非金屬性 F>Cl>Br | D. | 穩定性 HCl>H2S>PH3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com