

分析 前四周期元素中,A原子核外的電子有1種運動狀態,則A為H元素;B的s能級電子數是p能級的2倍,原子核外電子排布式為1s22s22p2,則B為C元素;D、E為同主族元素,且E的原子序數為D的2倍,則D為O元素、E為S元素;C原子序數介于碳、氧之間,則C為N元素;B和F可形成最常見且最常用的合金,則F為Fe.
(1)Fe元素高價離子為Fe3+,Fe原子核外電子排布式為1s22s22p63s23p63d64s2,失去4s能級2個電子、3d能級1個電子形成Fe3+;
(2)同周期元素第一電離能隨著原子序數增大而呈增大趨勢,但氮元素原子2p能級為半滿穩定狀態,能量較低,第一電離能高于同周期相鄰元素的;
(3)C和O形成的一種三原子分子為CO2,原子數目相等、價電子總數相等的微粒互為等電子體;
(4)A.每個C2H2分子結構式為H-C≡C-H;
B.H、N、O三種元素可以可以形成硝酸銨、硝酸等;
C.化合物C2H4是對稱結構,屬于非極性分子,碳原子之間形成非極性鍵、C原子與H原子之間形成極性鍵;
D.B、C、D分別為C、B、O,三種元素的基態原子具有相同的能層和能級;
(5)D、E的氫化物分別為H2O、H2S,水分子之間存在氫鍵,沸點高于硫化氫的,H2S分子中S原子價層電子對數為2+$\frac{6-1×2}{2}$=4;
(6)在面心立方晶胞中,以頂點F原子研究與之相鄰的原子處于面心,每個頂點為8個晶胞共用,每個面心為兩個晶胞共用;
根據均攤法計算面心立方晶胞、體心立方晶胞中F原子數目,進而計算晶胞質量之比,再根據ρ=$\frac{m}{V}$計算密度之比.
解答 解:前四周期元素中,A原子核外的電子有1種運動狀態,則A為H元素;B的s能級電子數是p能級的2倍,原子核外電子排布式為1s22s22p2,則B為C元素;D、E為同主族元素,且E的原子序數為D的2倍,則D為O元素、E為S元素;C原子序數介于碳、氧之間,則C為N元素;B和F可形成最常見且最常用的合金,則F為Fe.
(1)Fe元素高價離子為Fe3+,Fe3+的M層電子排布式為3s23p63d5,
故答案為:3s23p63d5;
(2)同周期元素第一電離能隨著原子序數增大而呈增大趨勢,但氮元素原子2p能級為半滿穩定狀態,能量較低,第一電離能高于同周期相鄰元素的,故第一電離能N>O>C,
故答案為:N>O>C;
(3)C和O形成的一種三原子分子為CO2,與N和O形成的一種化合物互為等電子體,則滿足上述條件的N和O形成的化合物的化學式是:N2O,
故答案為:N2O;
(4)A.每個C2H2分子中含有3個σ鍵、2個π鍵,故A錯誤;
B.H、N、O三種元素可以可以形成硝酸銨、硝酸等,前者屬于離子化合物,后者屬于共價化合物,故B正確;
C.化合物C2H4是對稱結構,屬于非極性分子,碳原子之間形成非極性鍵、C原子與H原子之間形成極性鍵,故C正確;
D.B、C、D分別為C、B、O,三種元素的基態原子具有相同的能層和能級,故D正確,
故選:BCD;
(5)D、E的氫化物分別為H2O、H2S,水分子之間存在氫鍵,沸點高于硫化氫的,H2S分子中S原子價層電子對數為2+$\frac{6-1×2}{2}$=4,價層電子對互斥模型為四面體形,S原子的雜化方式為sp3雜化,
故答案為:水分子之間存在氫鍵;四面體;sp3雜化;
(6)在面心立方晶胞中,以頂點F原子研究與之相鄰的原子處于面心,每個頂點為8個晶胞共用,每個面心為兩個晶胞共用,故F的配位數為$\frac{3×8}{2}$=12;
面心立方晶胞中F原子數目為8×$\frac{1}{2}$+6×$\frac{1}{2}$=4,體心立方晶胞中F原子數目為1+8×$\frac{1}{8}$=2,則晶胞質量之比為2:1,面心立方晶胞和體心立方晶胞棱長分別為acm、bcm,則F單質的面心立方晶胞和體心立方晶胞的密度之比為:$\frac{2}{{a}^{3}}$:$\frac{1}{{b}^{3}}$=2b3:a3,
故答案為:12;2b3:a3.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、電離能、化學鍵、等電子體、價層電子對互斥理論、雜化方式、氫鍵、晶胞計算等,是對物質結構主干知識的綜合考查,需要學生具備扎實的基礎,注意同周期第一電離能異常情況.


 第1卷單元月考期中期末系列答案
第1卷單元月考期中期末系列答案科目:高中化學 來源: 題型:選擇題
| A. | Cl2+H2O═HCl+HClO | B. | 3Fe+4H2O(g)$\frac{\underline{\;高溫\;}}{\;}$Fe3O4+4H2 | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | 2F2+2H2O═4HF+O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
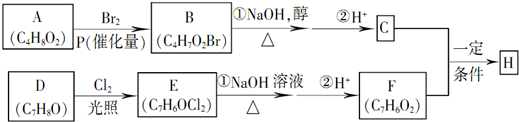
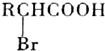
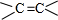 ;
;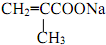 +NaBr+2H2O,該反應的類型為消去反應;
+NaBr+2H2O,該反應的類型為消去反應; $\stackrel{一定條件}{→}$
$\stackrel{一定條件}{→}$ +H2O.
+H2O.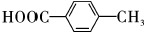 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

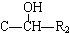 (R代表烴基或氫原子,下同.)
(R代表烴基或氫原子,下同.)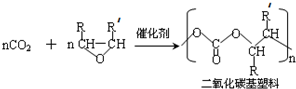
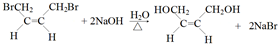 ,反應④的化學反應方程式
,反應④的化學反應方程式 ,反應⑤的化學反應方程式
,反應⑤的化學反應方程式
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ”的同分異構體有( )
”的同分異構體有( )| A. | 7種 | B. | 9種 | C. | 11種 | D. | 13種 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素H只有${\;}_1^1$H和${\;}_1^2$H兩種核素 | |
| B. | Cl2、NH4Cl中氯元素微粒的半徑:r(Cl)>r(Cl-) | |
| C. | 工業上常用干燥的鋼瓶儲存液氯,是因為鐵和氯氣在任何條件下都不反應 | |
| D. | 該反應表明常溫下氯氣有氧化性 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 1 mol FeBr2與足量氯氣反應時,理論上轉移的電子數約為3×6.02×1023 | |
| B. | 常溫下,pH均為3的三種溶液:①HCl溶液 ②H2SO4溶液③CH3COOH溶液,各自溶質的物質的量濃度大小順序為①=②<③ | |
| C. | 電解熔融NaCl或AlCl3制取Na或Al | |
| D. | 一定條件下反應Cr2O72-(aq)+H2O(l)?2CrO42-(aq)+2H+(aq)達到平衡后,滴加少量濃硫酸,重新達平衡前,2v正(Cr2O72-)<v逆(CrO42-) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | H2SO4是酸,因為H2SO4中含有氫元素 | |
| B. | 豆漿是膠體,因為豆漿中的分散質粒子直徑在1~100 nm之間 | |
| C. | Na在Cl2中燃燒屬于氧化還原反應,因為反應中有電子得失 | |
| D. | Na和H2O的反應不是離子反應,因為反應中沒有離子參加 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
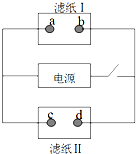 如圖中濾紙Ⅰ上浸有飽和食鹽水和酚酞,濾紙Ⅱ上浸有KMnO4溶液,接通電源一段時間后,發現a點附近變紅,則下列說法中正確的是( )
如圖中濾紙Ⅰ上浸有飽和食鹽水和酚酞,濾紙Ⅱ上浸有KMnO4溶液,接通電源一段時間后,發現a點附近變紅,則下列說法中正確的是( )| A. | a點和電源正極相連 | B. | b點發生還原反應 | ||
| C. | c點附近pH減小 | D. | d點附近顏色加深 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com