
| 物質 | Fe(OH)2 | Cu(OH)2 | Fe(OH)3 |
| KSP(25℃) | 8.0×10-16 | 2.2×10-20 | 4.0×10-38 |
| A. | 在pH=5的溶液中.Fe3+不能大量存在 | |
| B. | 混合溶液中c(SO42-):[c(Fe3+)+c(Fe2+)+c(Cu2+)]>5:4 | |
| C. | 向混合溶液中逐滴加入0.1mol•L-1NaOH溶液,最先看到紅褐色沉淀 | |
| D. | 向混合溶液中加入適量氯水,并調節pH到3~4過濾,可獲較純凈的CuSO4溶液 |
分析 A.根據溶度積計算;
B.Cu2+、Fe2+、Fe3+發生水解,因此它們的物質的量會減少;
C.根據Ksp的大小判斷溶解性;
D.加入氯水,能夠引入氯離子.
解答 解:A.在pH=5的溶液中c(H+)=10-5moL/L,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1×1{0}^{-9})^{3}}$mol/L=4×10-11mol/L,Fe3+不能大量存在,故A正確;
B.等物質的量的CuSO4、FeSO4、Fe2(SO4)3的溶液中設物質的量為1mol,n(SO42-)=5mol,n(Cu2+)+n(Fe2+)+n(Fe3+)=4mol,但Cu2+、Fe2+、Fe3+在水溶液中發生水解,所以該混合溶液中c(SO42-):{c(Cu2+)+c(Fe2+)+c(Fe3+)}>5:4,故B正確;
C、從表格中可以看出,Fe(OH)3的Ksp是最小的,所以它最先出現沉淀,故C正確;
D.加入氯水,能夠引入氯離子,得到氯化銅和硫酸銅的混合溶液,故D錯誤;
故選D.
點評 本題考查氧化還原反應順序判斷,離子沉淀條件的分析判斷,鹽類水解的應用,除雜實驗方法的應用,題目難度中等.


 海淀課時新作業金榜卷系列答案
海淀課時新作業金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 輕松課堂標準練系列答案
輕松課堂標準練系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | >7 | B. | <7 | C. | =7 | D. | 無法判斷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CHCl3只有一種結構 | |
| B. | CH2Cl2只有一種結構 | |
| C. | CH4是非極性分子 | |
| D. | CH4的四個價鍵的鍵長和鍵能都相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2H原子中的中子和質子 | |
| B. | Be2+離子中的質子和電子 | |
| C. | NaHCO3晶體中的陽離子和陰離子 | |
| D. | BaO2(過氧化鋇)固體中的陰離子和陽離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
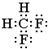 ;下列對于乙的描述正確的是d.
;下列對于乙的描述正確的是d.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C3H6、C3H8O | B. | C3H6、C2H6O | C. | C2H2、C6H6 | D. | CH4O、C2H4O3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲醛的電子式: | B. | 對甲基苯酚的結構簡式: | ||
| C. | 乙醇分子的比例模型: | D. | 3,3-二甲基-1-戊烯的鍵線式: |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com