


分析 (1)由質量守恒定律可知,還生成硅酸鈉;
(2)提高浸出率,可酸洗或延長水洗的時間等;
(3)Al2O3、SiO2、Fe2O3中前二者可以和氫氧化鈉之間發生反應,分別得到:偏鋁酸鈉溶液和硅酸鈉溶液,據此回答;
(4)ZrOCl2•8H2O在900℃分解生成ZrO2,SiCl4與NaOH溶液反應得到硅酸鈉、氯化鈉的混合液,依據流程產物結合原子守恒判斷產物寫出化學方程式;
(5)丁烷具有還原性,為原電池的負極,被氧化,電極反應式為C4H10+13O2--26e-=4CO2+5H2O,通入空氣的一極為原電池的正極,發生還原反應,電極反應式為O2+4e-=2O2-,總反應式為2C4H10+13O2→8CO2+10H2O,以此解答該題,注意電解質和離子的定向移動方向;
(6)根據Zr元素守恒以及元素的利用率進行相應計算即可.
解答 解:(1)由質量守恒定律可知,還生成硅酸鈉,則該反應為ZrSiO4 +4NaOH=Na2ZrO3+Na2SiO3,+2H2O,故答案為:Na2SiO3,2H2O;
(2)提高浸出率,實現Na2ZrO3、Na2SiO3的分離,可酸洗、將原料粉碎增大接觸面積、加熱、攪拌、多次浸取或延長水洗的時間等,故答案為:將原料粉碎增大接觸面積、加熱、攪拌、多次浸取(列舉兩種);
(3)Al2O3、SiO2、Fe2O3中前二者可以和氫氧化鈉之間發生反應,分別得到:偏鋁酸鈉溶液和硅酸鈉溶液,所得到的濾液中,除了OH-、ZrO32-外,還有陰離子是SiO32-、AlO2-,故答案為:SiO32-、AlO2-;
(4)ZrOCl2•8H2O在900℃生成ZrO2的反應方程式由流程可知分解生成ZrO2,H2O,由原子守恒可知產物中還有HCl,反應的化學方程式為ZrOCl2•8H2O$\frac{\underline{\;900℃\;}}{\;}$ZrO2+2HCl↑+7H2O↑,SiCl4與NaOH溶液反應得到硅酸鈉、氯化鈉的混合液,即:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;故答案為:ZrOCl2•8H2O$\frac{\underline{\;900℃\;}}{\;}$ZrO2+2HCl↑+7H2O↑;SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
(5)原電池中陰離子向負極移動,陽離子向正極移動,通入丁烷一極是負極,由于電解質為非水物質,則電解質中不存在OH-離子,正確的電極反應式為C4H10+13O2--26e-=4CO2+5H2O;通入空氣的一極為原電池的正極,發生還原反應,電極反應式為O2+4e-=2O2-,故答案為:負;C4H10-26e-+13O2-=4CO2+5H2O;
(6)根據Zr元素守恒,得到鋯英石ZrSiO4(91.5%)~ZrO2,所以得到ZrO2的物質的量是$\frac{5×1{0}^{6}×91.5%×80%}{183}$mol=2×104mol,質量是2×104mol×123g/mol=2.46××106g=2.46t,故答案為:2.46.
點評 本題考查了物質制備的流程,涉及混合物分離、提純及化學方程式的方法、物質性質的應用、原電池反應原理的應用及電極反應書寫,綜合性較強,注意原電池電解質不是電解質溶液,題目難度較大.


 全優點練單元計劃系列答案
全優點練單元計劃系列答案科目:高中化學 來源: 題型:選擇題
| A. | 半導體材料碳化硅 | B. | 超導材料銅鋅合金 | ||
| C. | 透明陶瓷材料硒化鋅 | D. | 超導材料Cs3C60 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 同溫同壓下,物質的物質的量越大,體積也越大 | |
| B. | 同溫同壓下,氣體的物質的量越大,體積也越大 | |
| C. | 同溫同壓下,同體積的氣體具有相同的原子數 | |
| D. | 體積相同的氣體,所含分子數也相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 序號 | 實驗步驟 | 預期現象 | 結論 |
| 1 | |||
| 2 | 錐形瓶中液體含大量Br- | ||
| 3 | 錐形瓶中液體含大量H+ |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:解答題
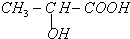 ,現以A為主要原料合成乙酸乙酯,其合成路線如圖所示.
,現以A為主要原料合成乙酸乙酯,其合成路線如圖所示.
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. (用相關的化學用語作答).
(用相關的化學用語作答).| 元素 | Mn | Fe |
| 電離能 | ||
| (kJ•mol-1) | ||
| I1 | 717 | 759 |
| I2 | 1 509 | 1561 |
| I3 | 3 248 | 2 957 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

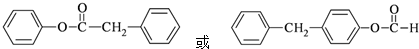 .
. $→_{Pd/C}^{H_{2}}$
$→_{Pd/C}^{H_{2}}$ .化合物
.化合物  是合成抗癌藥物美發倫的中間體,請寫出以
是合成抗癌藥物美發倫的中間體,請寫出以  和
和 為原料制備該化合物的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:
為原料制備該化合物的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com