
| A. | 10 mL 0.1 mol/L氨水與10 mL 0.1 mol/L鹽酸混合:c(Cl->c(NH4+)>c(OH-)>c(H+) | |
| B. | 10 mL 0.1 mol/L NH4Cl溶液與5mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(Cl-)>c(OH-)>c(H+) | |
| C. | 10 mL 0.1 mol/L CH3COOH溶液與5 mL 0.2 mol/L NaOH溶液混合:c(Na+)=c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 10 mL 0.5 mol/L CH3COONa溶液與6 mL 1 mol/L鹽酸混合:c(Cl-)>c(Na+)>c(OH-)>c(H+) |
分析 A.物質的量相同的氨水和鹽酸混合,二者恰好反應生成氯化銨,氯化銨是強酸弱堿鹽,銨根離子水解導致溶液呈酸性,但其水解程度較小;
B.10 mL 0.1 mol/L NH4Cl溶液與5mL 0.2 mol/L NaOH溶液混合,二者恰好反應生成氯化鈉和一水合氨,一水合氨電離導致溶液呈堿性,但其水解程度較小;
C.10 mL 0.1 mol/L CH3COOH溶液與5 mL 0.2 mol/L NaOH溶液混合,二者物質的量相等,二者恰好反應生成醋酸鈉,醋酸根離子水解導致溶液呈堿性,但其水解程度較小;
D.10 mL 0.5 mol/L CH3COONa溶液與6 mL 1 mol/L鹽酸混合,鹽酸的物質的量大于醋酸鈉,鹽酸過量,反應后溶液中溶質為醋酸、氯化鈉、鹽酸,溶液呈酸性.
解答 解:A.物質的量相同的氨水和鹽酸混合,二者恰好反應生成氯化銨,氯化銨是強酸弱堿鹽,銨根離子水解導致溶液呈酸性,但其水解程度較小,所以離子濃度大小順序是c(Cl->c(NH4+)>c(H+)>c(OH-),故A錯誤;
B.10 mL 0.1 mol/L NH4Cl溶液與5mL 0.2 mol/L NaOH溶液混合,二者恰好反應生成氯化鈉和一水合氨,一水合氨電離導致溶液呈堿性,c(OH-)>c(H+),但其水解程度較小,根據物料守恒得c(Na+)=c(Cl-),離子濃度大小順序是c(Na+)=c(Cl-)>c(OH-)>c(H+),故B正確;
C.10 mL 0.1 mol/L CH3COOH溶液與5 mL 0.2 mol/L NaOH溶液混合,二者物質的量相等,二者恰好反應生成醋酸鈉,醋酸根離子水解導致溶液呈堿性,所以得c(Na+)>c(CH3COO-)、c(OH-)>c(H+),但其水解程度較小,離子濃度大小順序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故C錯誤;
D.10 mL 0.5 mol/L CH3COONa溶液與6 mL 1 mol/L鹽酸混合,鹽酸的物質的量大于醋酸鈉,鹽酸過量,反應后溶液中溶質為醋酸、氯化鈉、鹽酸,溶液呈酸性,則c(H+)>c(OH-),根據物料守恒得c(Cl-)>c(Na+),離子濃度大小順序是c(Cl-)>c(Na+)>c(H+)>c(OH-),故D錯誤;
故選B.
點評 本題考查離子濃度大小比較,為高頻考點,明確混合溶液中溶質成分及其性質是解本題關鍵,會根據溶質確定溶液酸堿性,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 0.1 mol•L-1CH3COONa溶液與0.1 mol•L-1HCl溶液等體積混合:c(Na+)=c(Cl-)>c(CH3COO-)>c(H+) | |
| B. | 0.1 mol•L-1NH4Cl溶液與0.1 mol•L-1氨水等體積混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol•L-1Na2CO3溶液與0.1 mol•L-1NaHCO3溶液等體積混合:$\frac{2}{3}$c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 0.1 mol•L-1Na2C2O4溶液與0.1 mol•L-1HCl溶液等體積混合(H2C2O4為二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室用干燥而純凈的二氧化硫和氯氣合成硫酰氯,裝置如圖所示(夾持儀器已省略),請回答有關問題:
實驗室用干燥而純凈的二氧化硫和氯氣合成硫酰氯,裝置如圖所示(夾持儀器已省略),請回答有關問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
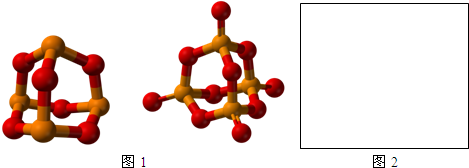
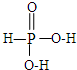 ,寫出H3PO2與足量氫氧化鈉溶液反應的化學方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三種含氧酸H3PO2、H3PO3、H3PO4的酸性強弱順序為H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合價依次為+1,+3和+5價,中心磷原子的正電荷依次升高,導致P-O-H中O的電子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易電離出氫離子,酸性越來越強.
,寫出H3PO2與足量氫氧化鈉溶液反應的化學方程式NaOH+H3PO2=Na H2PO2+H2O.磷的三種含氧酸H3PO2、H3PO3、H3PO4的酸性強弱順序為H3PO2<H3PO3<H3PO4,其原因是H3PO2、H3PO3、H3PO4中磷元素的化合價依次為+1,+3和+5價,中心磷原子的正電荷依次升高,導致P-O-H中O的電子更易向P偏移,因而H3PO2、H3PO3、H3PO4越易電離出氫離子,酸性越來越強.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 A、B、C、D、E、F為周期表中前36號元素,它們的原子序數依次增大.A元素原子的核外p電子總數比s電子總數少1;B元素原子核外s電子總數與p電子總數相等,且不與A元素在同一周期,C原子最外層電子數是其電子總數的$\frac{1}{3}$;D元素的主族序數與周期數的差為4;E是前四周期中電負性最小的元素;F在周期表的第10列.
A、B、C、D、E、F為周期表中前36號元素,它們的原子序數依次增大.A元素原子的核外p電子總數比s電子總數少1;B元素原子核外s電子總數與p電子總數相等,且不與A元素在同一周期,C原子最外層電子數是其電子總數的$\frac{1}{3}$;D元素的主族序數與周期數的差為4;E是前四周期中電負性最小的元素;F在周期表的第10列.
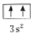 違背了泡利原理.
違背了泡利原理.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{22.4}{Vn}$ | B. | $\frac{22.4n}{V}$ | C. | $\frac{Vn}{5.6}$ | D. | $\frac{5.6n}{V}$ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com