
分析 加鐵粉,發生反應Fe+2Fe3+=3Fe2+,根據反應可知0.2molFe3+完全被還原只需要0.1molFe,從而可計算出反應后溶液中亞鐵離子的物質的量,然后根據c=$\frac{n}{V}$計算出反應后溶液中Fe2+的物質的量濃度.
解答 解:加入鐵粉,發生Fe+2Fe3+=3Fe2+,溶液中含0.2molFe3+,待Fe3+完全還原后,由反應可知消耗Fe的物質的量為:0.2mol×$\frac{1}{2}$=0.1mol,
Fe有剩余,反應生成Fe2+為0.2mol×$\frac{3}{2}$=0.3mol,則反應后溶液中含Fe2+的物質的量為:0.1mol+0.3mol=0.4mol,
所以溶液中Fe2+的物質的量濃度為:$\frac{0.4mol}{0.5L}$=0.8mol/L,
故答案為:0.8mol/L.
點評 本題考查了物質的量濃度的計算,題目難度不大,明確發生反應的實質為解答關鍵,注意掌握物質的量濃度的概念及表達式,試題培養了學生的分析能力及化學計算能力.


科目:高中化學 來源: 題型:解答題
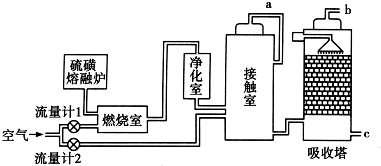
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
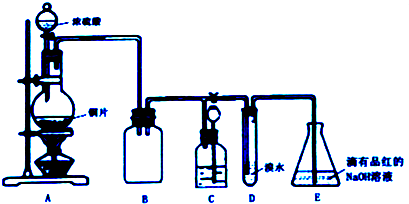
| 實驗序號 | 實驗操作 | 現象 | 反應的可能情況 |
| ① | 滴加少量淀粉碘化鉀溶液,振蕩 | III | |
| ② | 滴加少量棕紅色的KI3溶液,振蕩 | II | |
| ③ | 滴入加少量酸性KMnO4溶液,振蕩 | 溶液呈紫色 | |
| ④ | 加入幾小塊CaCO3固體 | 有氣泡產生 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CaCO3、BaSO4、Na2CO3 | B. | CuSO4、NaCl、NaCO3 | ||
| C. | NaCl、CuSO4、CaCO3 | D. | NaCl、KNO3、BaCl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
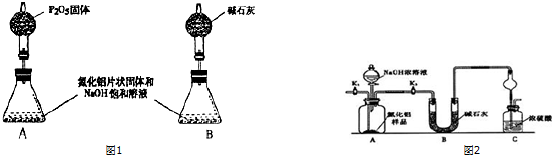
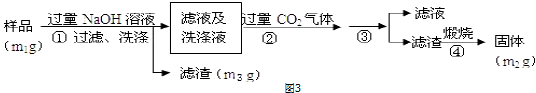
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
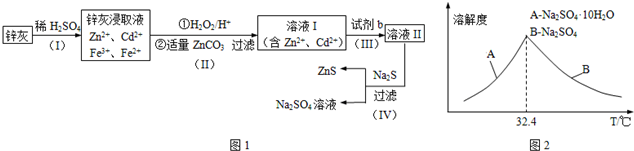
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
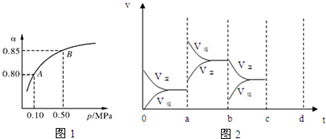
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com