
【題目】Ⅰ.硫和氮的氧化物直接排放會引發嚴重的環境問題,請回答下列問題:
(1)下列環境問題主要由硫氧化物和氮氧化物的排放引發的是___________。
A.全球變暖 B.酸雨 C.水體富營養化(水華) D.白色污染
(2)SO2的排放主要來自于煤的燃燒。常用石灰石脫硫,其產物可以做建筑材料。
已知:CaCO3(s)= CO2(g)+CaO(s) △H=+178.2kJ/mol
SO2(g)+CaO(s)= CaSO3(s) △H=-402kJ/mol
2CaSO3(s)+O2(g )= 2CaSO4(s) △H=-234.2kJ/mol
寫出石灰石脫硫的熱化學反應方程式___________________________。
Ⅱ.NOx的排放主要來自于汽車尾氣,包含NO2和NO,有人提出用活性炭對NOx進行吸附,發生反應如下:
反應a:C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol
N2(g)+CO2(g) △H=-34.0kJ/mol
反應b:2C(s)+2NO2(g)![]() N2(g)+2CO2(g) △H=-64.2kJ/mol
N2(g)+2CO2(g) △H=-64.2kJ/mol
(3)對于反應a,在T1℃時,借助傳感器測得反應在不同時間點上各物質的濃度如下:

①0~10min內,NO的平均反應速率v(NO)=___________,當升高反應溫度,該反應的平衡常數K___________(選填“增大”、“減小”或“不變”)。
②30min后,只改變某一條件,反應重新達到平衡;根據上表中的數據判斷改變的條件可能是___________(填字母)。
A.加入一定量的活性炭 B.通入一定量的NO
C適當縮小容器的體積 D.加入合適的催化劑
(4)某實驗室模擬反應b,在密閉容器中加入足量的C和一定量的NO2氣體,維持溫度為T2℃,如圖為不同壓強下反應b經過相同時間NO2的轉化率隨著壓強變化的示意圖。請從動力學角度分析,1050kPa前,反應b中NO2轉化率隨著壓強增大而增大的原因_____________;在1100kPa時,NO2的體積分數為___________。

(5)用某物質的平衡分壓代替其物質的量濃度也可以表示化學平衡常數(記作Kp);在T2℃、1.1×106Pa時,該反應的化學平衡常數Kp=___________(計算表達式表示);已知:氣體分壓(P分)=氣體總壓(P總)×體積分數。
【答案】B 2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) △H=-681.8kJ/mol 0.042mol/(Lmin) 減小 BC 1050kPa前反應未達平衡狀態,隨著壓強增大,反應速率加快,NO轉化率提高 50% 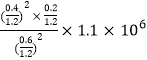 或
或
【解析】
(1)硫氧化物和氮氧化物的排放引發酸雨、光化學煙霧等;
(2)利用蓋斯定律計算(①+②)×2+③,整理可得到石灰石脫硫的熱化學反應方程式;
(3)①0~10min內,NO的平均反應速率v(NO)=![]() ,反應為放熱反應,升溫平衡逆向進行;
,反應為放熱反應,升溫平衡逆向進行;
②30min后,只改變某一條件,反應重新達到平衡,C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol,依據圖表數據分析,平衡狀態物質濃度增大,依據平衡常數計算K,平衡常數隨溫度變化,平衡常數不變說明改變的條件一定不是溫度;依據數據分析,氮氣濃度增大,二氧化碳和一氧化氮濃度增大,反應前后氣體體積不變,所以可能是減小溶液體積后加入一定量一氧化氮;
N2(g)+CO2(g) △H=-34.0kJ/mol,依據圖表數據分析,平衡狀態物質濃度增大,依據平衡常數計算K,平衡常數隨溫度變化,平衡常數不變說明改變的條件一定不是溫度;依據數據分析,氮氣濃度增大,二氧化碳和一氧化氮濃度增大,反應前后氣體體積不變,所以可能是減小溶液體積后加入一定量一氧化氮;
(4)1050kPa前,反應b中NO2轉化率隨著壓強增大而增大的原因,1050KPa前反應未達平衡狀態,隨著壓強增大,反應速率加快,在1100kPa時二氧化氮轉化率40%,結合三行計算列式得到;
(5)在T2℃、在1100kPa時二氧化氮轉化率40%,結合三行計算列式得到;設通入二氧化氮2mol,2C(s)+2NO2(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量 2 0 0
變化量2×40%=0.80.4 0.8
平衡量1.2 0.4 0.8
Kp=![]() 計算。
計算。
(1)硫氧化物和氮氧化物的排放引發酸雨、光化學煙霧等;
A.全球變暖是二氧化碳,A錯誤;
B.硫氧化物和氮氧化物的排放引發硫酸型酸雨和硝酸型酸雨,B正確;
C.水體富營養化(水華)是磷元素過量排放,C錯誤;
D.白色污染是聚乙烯、聚氯乙烯等塑料制品造成,D錯誤;
故合理選項是B;
(1)已知:①CaCO3(s)=CO2(g)+CaO(s)△H=+178.2kJ/mol
②SO2(g)+CaO(s)═CaSO3(s)△H=-402kJ/mol
③2CaSO3(s)+O2(g)═2CaSO4(s)△H=-234.2kJ/mol
根據蓋斯定律,將 (①+②)×2+③,整理可得:得到石灰石脫硫的熱化學反應方程式:2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) △H=-681.8kJ/mol;
(3)①C(s)+2NO(g)![]() N2(g)+CO2(g) △H=-34.0kJ/mol,圖表數據得到0~10min內,NO的平均反應速率v(NO)=
N2(g)+CO2(g) △H=-34.0kJ/mol,圖表數據得到0~10min內,NO的平均反應速率v(NO)=![]() =0.042mol/(Lmin),由于該反應的正反應為放熱反應,所以升高溫度,化學平衡向吸熱的逆反應方向移動,故化學平衡常數減小;
=0.042mol/(Lmin),由于該反應的正反應為放熱反應,所以升高溫度,化學平衡向吸熱的逆反應方向移動,故化學平衡常數減小;
②30min后,只改變某一條件,反應重新達到平衡,C(s)+2NO(g)![]() N2(g)+CO2(g),依據圖表數據分析,平衡狀態物質濃度增大,依據平衡常數計算K=
N2(g)+CO2(g),依據圖表數據分析,平衡狀態物質濃度增大,依據平衡常數計算K=![]() =
=![]() ,平衡常數會隨溫度變化,而平衡常數不變說明改變的條件一定不是溫度;依據數據分析,氮氣濃度增大,二氧化碳和一氧化氮濃度增大,反應前后氣體體積不變,所以可能是減小容器體積后加入一定量一氧化氮;
,平衡常數會隨溫度變化,而平衡常數不變說明改變的條件一定不是溫度;依據數據分析,氮氣濃度增大,二氧化碳和一氧化氮濃度增大,反應前后氣體體積不變,所以可能是減小容器體積后加入一定量一氧化氮;
A.加入一定量的活性炭,炭是固體物質,對化學平衡無影響,平衡不移動,A錯誤;
B.通入一定量的NO,新平衡狀態下物質平衡濃度增大,B正確;
C.適當縮小容器的體積,反應前后體積不變,平衡狀態物質濃度增大,C正確;
D.加入合適的催化劑,催化劑只改變化學反應速率,不能使化學平衡移動,D錯誤;
故合理選項是BC;
(4) 1050KPa前反應未達平衡狀態,增大壓強,物質的濃度增大,反應速率加快,NO轉化率提高,在1100kPa時二氧化氮轉化率40%,結合三行計算列式得到;設通入二氧化氮2mol,
2C(s)+2NO2(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量 2 0 0
變化量2×40%=0.80.4 0.8
平衡量1.2 0.4 0.8
NO2的體積分數=![]() ×100%=50%;
×100%=50%;
(5)在1100kPa時二氧化氮轉化率40%,結合三行計算列式得到;設通入二氧化氮mol,
2C(s)+2NO2(g)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始量1 0 0
變化量1×40%=0.40.2 0.4
平衡量0.6 0.20.4
氣體總物質的量=1.2mol, Kp=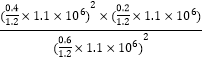 =
=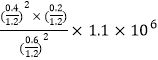 Pa。
Pa。


科目:高中化學 來源: 題型:
【題目】六苯乙烷為白色固體,其結構如圖,下列有關說法正確的是

A. 它是一種飽和烴,易溶于有機溶劑中
B. 它的分子式為C38H30,只含有非極性鍵
C. 它的一氯代物只有三種
D. 在同一平面上的原子最多有14個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將 4mol A氣體和 2mol B氣體在 2L 固定體積的容器中混合并在一定條件下發生如下反應:2A(g)+B(g)2C(g).若經2s后測得 C 的濃度為 0.6 molL-1,現有下列幾種說法,其中正確的是
A. 用物質A表示的反應的平均速率為0.2 molL-1s-1 B. 2s時物質B的濃度為0.7 molL-1
C. 用物質B表示的反應的平均速率為0.1 molL-1s-1 D. 2s時物質A的轉化率為70%
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銻(Sb)廣泛用于生產各種阻燃劑、陶瓷、半導體元件、醫藥及化工等領域。以輝銻礦為原料制備金屬銻,其一種工藝流程如下:

已知部分信息如下:
I.輝銻礦(主要成分為Sb2S3,還含有As2S5、PbS、CuO和SiO2等);
Ⅱ.浸出液主要含鹽酸和SbCl3,還含SbCl2、CuCl2、AsCl3和PbCl2等雜質;
Ⅲ.常溫下,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列問題:
(1)NaH2PO2中P的化合價為___________。
(2)“酸浸”過程中SbCl3和Sb2S3反應有S生成,該反應的還原產物是___________(填化學式)。
(3)寫出“還原”反應的化學方程式:_________________________________。
(4)已知:浸出液中C(Cu2+)=0.01mo/L、C(Pb2+)=0.1mo/L。在沉淀銅、鉛過程中,緩慢滴加極稀的硫化鈉溶液,先產生的沉淀是______________________(填化學式);當CuS、PbS共沉時,![]() ___________。
___________。
(5)在“除砷”過程中,氧化產物為H3PO4。該反應中氧化劑還原劑的物質的量之比為_______。常溫下,SbCl2溶液的pH<7,用離子方程式表示其原因:_____________________。
(6)在“電解”過程中,以惰性材料為電極,陰極的電極反應式為______________________;“電解”中銻的產率與電壓大小關系如圖所示。當電壓超過U0V時,銻的產率降低的原因可能是______________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】燒硫酸鋁銨晶體,發生的主要反應為4[NH4Al(SO4)2·12H2O] ![]() 2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。將產生的氣體通過下圖所示的裝置(假設試劑均過量)。下列說法正確的是
2A12O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O。將產生的氣體通過下圖所示的裝置(假設試劑均過量)。下列說法正確的是

A. 反應中硫元素既體現氧化性又體現還原性
B. 裝置Ⅰ中可以觀察到出現白色沉淀,其主要成分是BaSO4和BaSO3
C. 裝置Ⅱ中可以觀察到高錳酸鉀紫色褪去
D. 將裝置Ⅰ、Ⅱ順序交換,仍能觀察到相同的現象
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某同學設計如下實驗方案,以分離KCl和BaCl2兩種固體混合物,試回答下列問題:

(1)操作①的名稱是_____,操作②的名稱是____。
(2)試劑a是_____(填化學式,下同),試劑b是____,固體B是_____。
(3)加入試劑a所發生反應的化學方程式為_______________________。加入試劑b所發生反應的化學方程式為_______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學反應伴隨著能量的變化。下列過程中的能量變化不是由化學反應引起的是( )
A. 干冰升華B. 酸堿中和
C. 天然氣燃燒D. Ba(OH)28H2O晶體與NH4Cl晶體混合并攪拌
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高溫下,某反應達平衡,平衡常數K=![]() 。恒容時,溫度升高,H2濃度減小。下列說法正確的是
。恒容時,溫度升高,H2濃度減小。下列說法正確的是
A. 該反應的焓變為正值
B. 恒溫恒容下,通入N2,壓強增大,反應速率加快
C. 升高溫度,正反應速率加快,逆反應速率減慢,平衡正向移動
D. 該反應化學方程式為CO+H2O![]() CO2+H2
CO2+H2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知t ℃時,0.01 mol/L NaOH溶液的pH=11,0.1 mol/L的HA溶液中c(H+)/c(OH-)=109
請回答下列問題:
(1)該溫度下,水的離子積Kw=_____,0.1 mol/L的HA溶液中水電離出的c(OH-)=_____。
(2)在室溫下,將pH之和為14的NaOH溶液和HA溶液等體積混合后,所得溶液呈_____(填“酸”“堿”或“中”)性。
(3)在室溫下,蒸餾水稀釋0.01 mol/L HA溶液時,下列呈減小趨勢的是_____。
A.水的電離程度 B.c(HA)/c(A-)
C.溶液中c(H+)和c(OH-)的乘積 D.溶液中c(A-)·c(HA)的值
(4)室溫下,取pH=2的鹽酸和HA溶液各100 mL,向其中分別加入適量的Zn粒,反應過程中兩溶液的pH變化如圖所示:
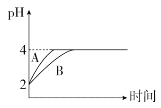
①圖中表示HA溶液pH變化曲線的是____(填“A”或“B”)。
②設鹽酸中加入Zn的質量為m1,HA溶液中加入Zn的質量為m2,則m1_____m2(填“>”“<”或“=”)。
(5)室溫下,取0.01 mol/L的鹽酸和HA溶液各100 mL,分別滴加0.01 mol/LNaOH溶液至恰好完全反應,所需NaOH溶液的體積前者____后者(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com