
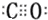 .
.
分析 (1)電子云形象的描述了一定空間運動狀態的電子在原子核外出現的概率密度分布;
基態14C原子的核外電子排布為1s22s22p2,1s、2s為成對電子,自旋方向相反,2p能級為單電子,自旋方向相同;
(2)一個碳原子有四個共價鍵,其中任意兩條邊(共價鍵)可以構成2個不同的六元環,根據組合知識可知四條邊任選其中兩條有6組;六元環中有兩條邊平衡,連接的原子處于同一平面內;金剛石晶胞中有4個原子處于晶胞內部,其它碳原子處于頂點與面心,利用均攤法計算;
(3)原子總數相等、價電子總數也相等的微粒互為等電子體,等電子體結構相似;
(4)C60分子中每個碳原子只跟相鄰的3個碳原子相連,每條棱為1個C原子提供$\frac{1}{2}$,可得棱的數目,而單鍵與雙鍵數目之和等于棱數,每個碳原子形成2個單鍵、1個雙鍵,而每個五邊形含有5個單鍵;
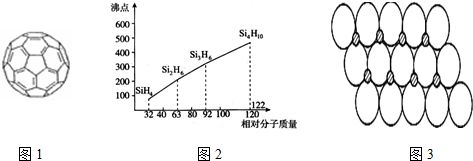
(5)硅烷(SinH2n+2)為分子晶體,相對分子質量越大,分子間作用力越強,沸點越高;
(6)根據氯化鈉的結構知,氧離子和相鄰的鎳離子之間的距離為$\frac{1}{2}$a,距離最近的兩個陽離子核間的距離是距離最近的氧離子和鎳離子距離的$\sqrt{2}$倍;
根據圖片知,每個氧化鎳所占的面積=(2×1.40×10-10m)×(2×1.40×10-10m×sin60°),每個氧化鎳的質量=$\frac{74.7}{{N}_{A}}$g,每個氧化鎳的質量乘以每平方米含有的氧化鎳個數就是每平方米含有的氧化鎳質量.
解答 解:(1)處于一定空間運動狀態的電子在原子核外出現的概率密度分布可用電子云形象化描述;基態14C原子的核外電子排布為1s22s22p2,1s、2s為成對電子,自旋方向相反,2p能級為單電子,自旋方向相同,核外存在2對自旋相反的電子,
故答案為:電子云;2;
(2)一個碳原子有四個共價鍵,其中任意兩條邊(共價鍵)可以構成2個不同的六元環,根據組合知識可知四條邊任選其中兩條有6組,故每個碳原子連接六元環數目為6×2=12,六元環中有兩條邊平衡,連接的4個原子處于同一平面內,金剛石晶胞中有4個原子處于晶胞內部,其它碳原子處于頂點與面心,晶胞中含有碳原子數目為4+8×$\frac{1}{8}$+6×$\frac{1}{2}$=8,
故答案為:12;4;8;
(3)與N2互為等電子體的分子是CO,二者結構相似,CO分子的電子式為 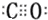 ,
,
故答案為:CO;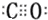 ;
;
(4)C60分子中每個碳原子只跟相鄰的3個碳原子相連,每條棱為1個C原子提供$\frac{1}{2}$,可得棱的數目為$\frac{60×3}{2}$=90,而單鍵與雙鍵數目之和等于棱數,每個碳原子形成2個單鍵、1個雙鍵,則晶體中單鍵數目為90×$\frac{2}{3}$=60,而每個五邊形含有5個單鍵,則含有五邊形數目為$\frac{60}{5}$=12,
故答案為:12;
(5)硅烷(SinH2n+2)為分子晶體,硅烷的相對分子質量越大,分子間范德華力越強,熔沸點越高,
故答案為:硅烷的相對分子質量越大,分子間范德華力越強,熔沸點越高;
(6)根據氯化鈉的結構知,氧離子和相鄰的鎳離子之間的距離為$\frac{1}{2}$a,距離最近的兩個陽離子核間的距離是距離最近的氧離子和鎳離子距離的$\sqrt{2}$倍,所以其距離是 $\frac{\sqrt{2}}{2}$acm;
根據圖片知,每個氧化鎳所占的面積=(2×1.40×10-10m)×(2×1.40×10-10m×sin60°)=4×1.40×10-10×1.40×10-10×sin60°m2,則每平方米含有的氧化鎳個數=$\frac{1}{4×1.4×1{0}^{-10}×1.4×1{0}^{-10}×sin60°}$,每個氧化鎳的質量=$\frac{74.7}{{N}_{A}}$g,所以每平方米含有的氧化鎳質量=$\frac{74.7}{{N}_{A}}$g×$\frac{1}{4×1.4×1{0}^{-10}×1.4×1{0}^{-10}×sin60°}$=1.83×10-3,
故答案為:$\frac{\sqrt{2}}{2}$a;1.83×10-3.
點評 本題是對物質結構與性質的考查,涉及核外電子排布、等電子體、晶胞計算結構與計算等,側重考查晶胞有關問題,(2)中注意識記中學常見晶胞結構,(5)中注意計算“1NiO”的體積應包含孔隙體積,需要學生具備一定的空間想象與數學計算能力,掌握均攤法進行晶胞有關計算,難度較大.


 名師導航單元期末沖刺100分系列答案
名師導航單元期末沖刺100分系列答案 名校名卷單元同步訓練測試題系列答案
名校名卷單元同步訓練測試題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 麻黃堿適應于醫治因葡萄球菌和鏈球菌引起的血毒癥 | |
| B. | 胃酸過多,出現反胃、吐酸等現象時,可服用小蘇打 | |
| C. | 感冒發熱頭痛時,服用阿司匹林 | |
| D. | 因葡萄球菌等引起的發炎,注射青霉素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熒光蛋白是一種高分子化合物且能發生水解 | |
| B. | 用純堿溶液和鹽酸可以清洗鍋爐中的硫酸鈣 | |
| C. | 利用次氯酸鈉溶液的堿性對餐具和環境消毒 | |
| D. | 大量排放PM2.5、SO2、NOX等會形成霧霾 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 名稱 | 氧化鐵 | 碳酸鈉 | 碳酸氫鈉 |
| 俗名 | 鐵紅 | 小蘇打 | |
| 化學式 | Na2CO3 | NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
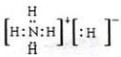 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ,很多不飽和有機物在E催化下可與H2加成反應:
,很多不飽和有機物在E催化下可與H2加成反應: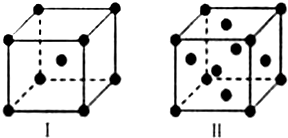
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 常溫常壓下的33.6 L氯氣與27 g鋁充分反應,轉移電子數為3NA | |
| B. | 常溫下,46 g分子式為C2H6O的物質中一定含有極性鍵為7NA,非極性鍵為NA | |
| C. | 125 mL 16 mol/L濃硫酸與足量的銅反應,生成SO2的分子數小于NA | |
| D. | 標準狀況下,體積為22.4 L NO2、N2O4的混合氣體,升溫至常溫,則混合氣體分子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
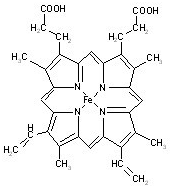 血紅素是血紅蛋白分子上的主要穩定結構,為血紅蛋白、肌紅蛋白的輔基,其分子結構如圖.
血紅素是血紅蛋白分子上的主要穩定結構,為血紅蛋白、肌紅蛋白的輔基,其分子結構如圖. )中有3個手性碳原子.
)中有3個手性碳原子.查看答案和解析>>
科目:高中化學 來源:2016-2017學年浙江省高一上10月月考化學試卷(解析版) 題型:選擇題
隱形眼鏡越來越受到年青人的喜愛,在使用隱形眼鏡時,常用的護理藥水中含有過氧化氫(H2O2).下列有關過氧化氫的說法中正確的是
A.過氧化氫是由氫氣和氧氣組成的
B.它是由2個氫元素和2個氧元素組成的
C.過氧化氫在二氧化錳作用下能生成水和氧氣,該反應為復分解反應
D.每個過氧化氫分子中含有2個氫原子和2個氧原子
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com