
【題目】無色溶液中含有:①Na+、②Ba2+、③Cl-、④Br-、⑤SO![]() 、⑥SO
、⑥SO![]() 、⑦Fe2+離子中的一種或幾種,依次進行下列實驗,且每步所加試劑均過量,觀察到的現象如下:
、⑦Fe2+離子中的一種或幾種,依次進行下列實驗,且每步所加試劑均過量,觀察到的現象如下:
步驟 | 操作 | 現象 |
① | 用pH試紙檢驗 | 溶液的pH大于7 |
② | 向溶液中滴加氯水,再加入CCl4振蕩,靜置 | CCl4層呈橙紅色 |
③ | 取②的上層溶液,加入Ba(NO3)2溶液和稀HNO3 | 有白色沉淀產生 |
④ | 將③過濾,向濾液中加入AgNO3溶液和稀HNO3 | 有白色沉淀產生 |
根據上述實驗現象,判斷以下結論中正確的是( )
A. 肯定含有的離子是①④⑤ B. 肯定沒有的離子是②⑤⑦
C. 可能含有的離子是①②⑥ D. 不能確定的離子是①③⑥
【答案】A
【解析】①Fe2+為淺綠色,溶液為無色說明不含Fe2+,用pH試紙檢驗溶液的pH大于7,說明溶液呈堿性,弱酸根離子水解顯堿性,所以一定存在SO32-,鋇離子能與亞硫酸根離子生成沉淀,所以一定不含Ba2+;根據溶液呈電中性原則,陽離子一定有Na+;
②向溶液中滴加氯水,再加入CCl4振蕩,靜置CCl4層呈橙色,說明溶液中含有Br-;③向所得水溶液中加入Ba(NO3)2溶液和稀HNO3有白色沉淀產生,該沉淀為硫酸鋇沉淀,但不能說明溶液中是否含有SO42-離子,也可能是SO32-離子被氧化生成;④過濾,向濾液中加入AgNO3溶液和稀HNO3有白色沉淀產生,該沉淀為AgCl,但不能確定溶液中是否含有Cl-,因所加氯水中含有Cl-。所以:原溶液中一定含有Na+、Br-、SO32-,不能確定的有Cl-、SO42-,一定不含有Fe2+、Ba2+,故選:A。


科目:高中化學 來源: 題型:
【題目】下列物質的變化,能通過一步化學反應完成的是( )
A. Al→Al(OH)3 B. N2→NO2
C. SiO2→Na2SiO3 D. SiO2→H2SiO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】連二亞硫酸鈉(Na2S2O4)又稱保險粉,是印刷工業中重要的還原劑。某課題小組進行如下實驗:
Ⅰ.查閱資料
①連二亞硫酸鈉(Na2S2O4)是一種白色粉末,易溶于水,難溶于乙醇。
②2Na2S2O4+4HCl===4NaCl+S↓+3SO2↑+2H2O;
Na2S2O3+2HCl===2NaCl+S↓+SO2↑+H2O。
Ⅱ.制備方法
75 ℃時將甲酸鈉和純堿加入乙醇溶液中,通入SO2進行反應,完成其反應的化學方程式:
________HCOONa+________Na2CO3+________===________Na2S2O4+________CO2+______
冷卻至40~50 ℃,過濾,用________洗滌,干燥制得Na2S2O4。
Ⅲ.Na2S2O4的性質
(1)Na2S2O4溶液在空氣中易被氧化。課題小組測定0.050 mol·L-1 Na2S2O4溶液在空氣中pH變化如圖所示:
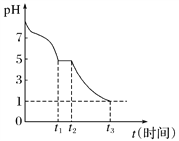
0~t1段主要生成HSO![]() ,根據pH變化圖,HSO
,根據pH變化圖,HSO![]() 的電離程度________(填“<”或“>”)水解程度。
的電離程度________(填“<”或“>”)水解程度。
0~t1段發生反應的離子方程式為_____________。
t3時溶液中存在的主要陰離子的符號是_________________。
(2)隔絕空氣加熱Na2S2O4固體完全分解;得到固體產物Na2SO3、Na2S2O3和________(填化學式)氣體。
請你設計實驗驗證產物有Na2S2O3存在,完成下表中內容。
(供選擇的試劑:稀鹽酸、稀硝酸、BaCl2溶液、KMnO4溶液)
實驗步驟(不要求寫出具體操作過程) | 預期的實驗現象和結論 |
______ | _________ |
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有7 種物質,①甲烷②苯③2一丁炔④環己烷⑤鄰二甲苯⑥環己烯⑦二氧化硫,既能使酸性高錳酸鉀溶液褪色又能與溴水反應使之褪色的是( )
A. ③⑥⑦ B. ②④⑥⑦ C. ②⑤⑥⑦ D. ④⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列離子在溶液中因發生氧化還原反應而不能大量共存的是( )
A. HCO3-、NH4+、H+、Cl- B. Al3+、OH-、Na+、Cl-
C. Na+、 H+ 、Fe2+、NO3- D. Mg2+、Fe3+、NO3-、SCN-
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海水開發利用的部分過程如圖所示。下列說法錯誤的是

A. 向苦鹵中通入Cl2是為了提取溴
B. 粗鹽可采用除雜和重結晶等過程提純
C. 工業生產中常選用NaOH作為沉淀劑
D. 富集溴一般先用空氣和水蒸氣吹出單質溴,再用SO2將其還原吸收
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A、B、C、D、E均為易溶于水的化合物,其離子組成如下表。(各化合物中離子組成不重復)
陽離子 | Na+、Al3+、Ag+、Ba2+、Fe3+ |
陰離子 | Cl-、CO32-、SO42-、NO3-、OH- |
分別取溶液進行如下實驗:
①用pH試紙分別測得B、C溶液均呈堿性,且0.1 molL B溶液pH>13;
②D溶液加入銅粉,溶液質量增加;
③在E溶液中逐滴滴入B至過量,先生成白色沉淀,后沉淀完全溶解;
④在A溶液中逐滴滴入氨水至過量,先生成白色沉淀,后沉淀完全溶解。
請回答下列問題:
(1)B的名稱;_______________,E的名稱;______________。
(2)C水溶液呈堿性原因:_____________(用離子方程式表示);0.1mol/L的C溶液中和0.1mol/L的NaHCO3溶液中,陰離子的總數:C溶液___________NaHCO3溶液。(填“>”或 “<”)
(3)D溶液呈________(填“酸性”“堿性”或“中性”)。若將D溶液加熱蒸干得到固體應是__________(填化學式)。若將E溶液加熱蒸干后再高溫灼燒得到固體應是___________ (填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在化學反應中,只有極少數能量比平均能量高得多的反應物分子發 生碰撞時才可能發生化學反應,這些分子被稱為活化分子。使普通分子變成活化分子所需提供的最低限度的能量叫活化能,其單位通常用 kJ/mol 表示。請認真觀察下圖,然后 回答問題。
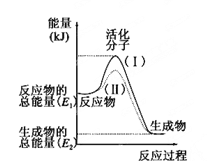
(1)圖中所示反應是_____(填“吸熱”或“放熱”)反應。
(2)已知拆開 1mol H—H 鍵、1mol I—I、1mol H—I 鍵分別需要吸收的能量為 436kJ、151kJ、299kJ。則由 1mol 氫氣和 1mol 碘反應生成 HI 會_____(填“放出”或“吸 收”)______kJ 的熱量。在化學反應過程中,是將_____轉化為_________。
(3)下列反應中,屬于放熱反應的是_____,屬于吸熱反應的是_____。
①物質燃燒 ②炸藥爆炸 ③酸堿中和反應 ④二氧化碳通過熾熱的碳
⑤食物因氧化而腐敗 ⑥Ba(OH)2·8H2O 與 NH4Cl 反應 ⑦鐵粉與稀鹽酸反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.所有族中IIIB中元素種類最多
B.p區都是主族元素
C.s區、d區、ds區都是金屬元素
D.最外層電子數為2的元素都分布在s區
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com