
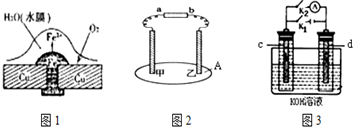
分析 (1)金屬在潮濕的空氣中易發生吸氧腐蝕,在原電池的正極是氧氣得電子的過程;
(2)用石墨作電極,通電后發現乙周圍濾紙褪色,說明乙處生成氯氣即為陽極,與之相連的b為正極,甲為陰極,與之相連的a為負極;
(3)斷開K2閉合K1一段時間,形成電解池,d和電源的負極相連,是陰極,該極上氫離子得電子放出氫氣,OH-向陽極移動;
斷開K1,閉合K2時,形成氫氧燃料電池,電極d處為氫氣是負極,電極c處為氧氣是正極,該極上發生得電子的還原反應,OH-向負極移動.
解答 解:(1)銅板上鐵鉚釘處容易生銹,是因為金屬鐵、銅、潮濕的空氣形成了原電池,其中活潑金屬鐵發生了吸氧腐蝕的結果,在該原電池的負極上是鐵失電子的過程,反應為Fe-2e-═Fe2+,
故答案為:鐵;Fe-2e-═Fe2+;
(2)用石墨作電極,通電后發現乙周圍濾紙褪色,說明乙處生成氯氣即為陽極,與之相連的b為正極,甲為陰極,與之相連的a為負極;故答案為:負;陽;
(3)斷開K2閉合K1一段時間,形成電解池,d和電源的負極相連,是陰極,氫離子得電子放出氫氣,電極反應式為:2H++2e-=H2↑,OH-向陽極c移動;
斷開K1,閉合K2時,形成氫氧燃料電池,電極d處為氫氣是負極,電極c處為氧氣是正極,該極上發生得電子的還原反應,電極反應式為:O2+H2O+4e-=4OH-,OH-向負極d移動,故答案為:2H++2e-=H2↑;c;O2+H2O+4e-=4OH-;d.
點評 本題考查了原電池以及電解池原理,明確離子放電順序是解本題關鍵,結合電極反應進行解答,難度中等.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | 熱穩定性:NH3>PH3>SiH4 | B. | 微粒半徑:K+>Na+>Mg2+>Al3+ | ||
| C. | 熔點:Al>Mg | D. | 電負性:F>N>O>C |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 已知可逆反應:Fe(s)+CO2(g)?FeO(s)+CO(g),其溫度與平衡常數K的關系如表:
已知可逆反應:Fe(s)+CO2(g)?FeO(s)+CO(g),其溫度與平衡常數K的關系如表:| T(K) | 938 | 1173 |
| K | 1.47 | 2.15 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 元素原子的核外電子排布的周期性變化 | |
| B. | 元素的相對原子質量逐漸增大 | |
| C. | 元素化合價的周期性變化 | |
| D. | 元素原子的核外電子層數的逐漸增多 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 將Zn棒和Cu棒用導線連接后,放入某電解質溶液中,構成如圖所示裝置.試回答下列問題:
將Zn棒和Cu棒用導線連接后,放入某電解質溶液中,構成如圖所示裝置.試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 某溫度時,在2L容器中X、Y、Z三種物質的物質的量隨時間變化曲線如圖所示,由圖中數據分析,該反應的化學方程式為X+3Y?2Z,反應開始至2min,反應的平均速率v(Z)=0.05mol•L-1•min-1.
某溫度時,在2L容器中X、Y、Z三種物質的物質的量隨時間變化曲線如圖所示,由圖中數據分析,該反應的化學方程式為X+3Y?2Z,反應開始至2min,反應的平均速率v(Z)=0.05mol•L-1•min-1.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com