
【題目】異丁烷脫氫制異丁烯反應為:![]() △H1=+124kJ·mol-1,副反應為裂解反應:
△H1=+124kJ·mol-1,副反應為裂解反應:![]() △H2=+84kJ·mol-1,異丁烷的轉化率(%)隨溫度和壓強的變化如圖,下列說法不正確的是
△H2=+84kJ·mol-1,異丁烷的轉化率(%)隨溫度和壓強的變化如圖,下列說法不正確的是
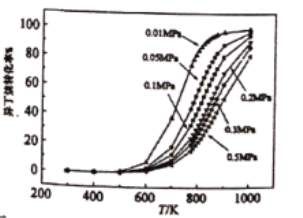
A.由圖可知,600~1000K范圍內,溫度不變,壓強增大,異丁烷脫氫反應的轉化率降低
B.在不同溫度、壓強下,轉化相同物質的量的異丁烷所需要的時間相等
C.使用催化劑可以加快反應速率,從而縮短反應達到平衡所需的時間
D.開發合適的催化劑,有效抑制副反應的發生,可提高異丁烯的選擇性
科目:高中化學 來源: 題型:
【題目】(1)25℃時,某FeCl3溶液的pH=2,則由水電離產生的總c(OH-)=____________;用離子方程式表示FeCl3溶液用于凈水的原因____________________________________。
(2)已知NaHSO4在水中的電離方程式NaHSO4=Na++H++SO42-。在NaHSO4溶液中c(H+)___________c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氫鈉與氫氧化鋇溶液制取硫酸鋇,若溶液中SO42-完全沉淀,則反應后溶液的pH__________7。
(3)將0.02mol/LNa2SO4溶液與某濃度BaCl2溶液等體積混合,則生成BaSO4沉淀所需原BaCl2溶液的最小濃度為_________________________________。(已知Ksp(BaSO4)=1.1×10-10)
(4)一定溫度下,測得某純水的pH為6.5。此時水的離子積常數Kw為_______;若在此純水中加一定量Ba(OH)2固體,配制成0.005mol·L-1的Ba(OH)2溶液,保持原溫度,其溶液的pH為__________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高錳酸鉀(KMnO4)是常用的氧化劑。以軟錳礦(主要成分是MnO2)為原料制備高錳酸鉀晶體的操作流程如下:
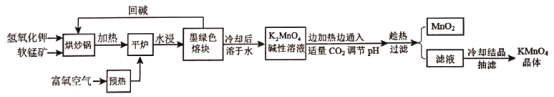
相關資料:①物質溶解度

②錳酸鉀[K2MnO4]
外觀性狀:墨綠色結晶。其水溶液呈深綠色,這是錳酸根(MnO42-)的特征顏色。
化學性質:在強堿性溶液中穩定,在酸性、中性和弱堿性中,MnO42-會發生岐化反應。
試回答下列問題:
(1)烘炒前,混配KOH和軟錳礦固體,將軟錳礦粉碎,其作用是_____,上述流程中趁熱過濾的目的是___。
(2)請寫出實驗中通入適量CO2時體系中可能發生反應的離子方程式:____。
(3)下列有關上述流程及操作說法正確的是_____。
A. 平爐中發生的反應中MnO2的作用是氧化劑
B. 流程中CO2用醋酸溶液代替,得到的產品純度更高,而不能用鹽酸和硫酸代替
C. 抽濾前,應先將濾紙放入布氏漏斗中,微開水龍頭,使濾紙緊貼漏斗的瓷板上
D. 抽濾完畢,先斷開水泵與吸濾瓶間的橡皮管,然后關閉水龍頭
(4)洗滌KMnO4晶體最好的試劑是______。
A. 無水乙醇 B. 乙醇水溶液 C. 氫氧化鉀溶液 D. 冷水
(5)晶體干燥時,溫度控制在80℃為宜,溫度不宜過高的理由是___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】設NA為阿伏加德羅常數的值,下列敘述不正確的是( )
A.80 g硝酸銨中含有氮原子數為NA
B.0.1 molN5+離子中所含的電子數為3.4NA
C.1 mol甲烷和NA個甲烷分子的質量相等
D.16 g氧氣和16 g臭氧所含的原子數均為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中正確的是( )
A.標準狀況下,22.4 L水中所含的分子數約為6.02×1023個
B.1 mol Cl2中含有的原子數為NA
C.標準狀況下,aL氧氣和氮氣的混合物含有的分子數約為![]() ×6.02×1023個
×6.02×1023個
D.常溫常壓下,11.2 L CO分子數是0.5NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體混合物溶解后的溶液可能含有Na+、K+、![]() 、
、![]() 、
、![]() 中的若干種,取該溶液進行連續實驗,實驗過程如下(所加試劑均過量,氣體全部逸出)。下列說法不正確的是
中的若干種,取該溶液進行連續實驗,實驗過程如下(所加試劑均過量,氣體全部逸出)。下列說法不正確的是
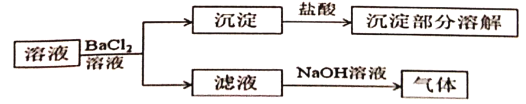
A.原固體可能是硫酸銨和碳酸鈉B.原固體可能是碳酸銨和硫酸鈉
C.原固體不可能是硫酸銨和碳酸鉀D.原固體不可能是碳酸鉀和硫酸鈉
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某固體混合物可能含有![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 中的一種或幾種,將該混合物進行如下實驗:
中的一種或幾種,將該混合物進行如下實驗:
①將少許混合物放入水中得到無色溶液和白色沉淀,過濾;
②取溶液進行焰色反應,火焰呈黃色;
③取白色沉淀加入稀鹽酸,沉淀完全溶解并放出氣體
由上述現象推斷:
(1)該混合物中一定含有________,一定不含有________,可能含有________。
(2)若要檢驗可能含有的物質是否存在,可以采用的實驗操作為_____(填寫字母)。
A.取步驟①中濾液,加入![]() 溶液
溶液
B.取步驟①中濾液,加入NaOH溶液
C.取步驟①中濾液,加入足量![]() 溶液,靜置后在上層清液中加入硝酸酸化
溶液,靜置后在上層清液中加入硝酸酸化![]() 溶液
溶液
D.取步驟①中濾液,加入足量![]() 溶液,靜置后上層清液中加入硝酸酸化
溶液,靜置后上層清液中加入硝酸酸化![]() 溶液
溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與社會、生活密切相關,對下列現象或事實的解釋不正確的是( )
選項 | 現象或事實 | 解釋或對應的離子方程式 |
A | 用熱的純堿溶液洗去油污 | CO32-+H2O 溶液呈堿性,溫度升高堿性增強 |
B | 酸雨樣品在空氣中放置pH減小 | SO2+H2O=H2SO3 |
C | 用泡沫滅火器滅火 | Al3++3HCO3-=Al(OH)3↓+3CO2↑ |
D | 用加熱法除去NaCl固體中混有的NH4Cl固體 | NH4Cl固體在加熱條件下可以完全分解成為氣體而除去 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、M、Q、R是6種短周期元素,其原子半徑及主要化合價如下:
元素代號 | X | Y | Z | M | Q | R |
原子半徑/nm | 0.160 | 0.143 | 0.102 | 0.075 | 0.077 | 0.037 |
主要化合價 | +2 | +3 | +6,-2 | +5,-3 | +4,-4 | +1 |
(1)Y在元素周期表中的位置是___。
(2)元素Q和R形成的化合物A是果實催熟劑,用A制備乙醇的化學方程式是___。
(3)單質銅和元素M的最高價氧化物對應水化物的稀溶液發生反應的離子方程式為___。
(4)元素X的金屬性比元素Y___(填“強”或“弱”),用原子結構的知識解釋原因___。
(5)元素Q、元素Z的含量影響鋼鐵性能,采用如圖裝置A在高溫下將鋼樣中元素Q、元素Z轉化為QO2、ZO2。
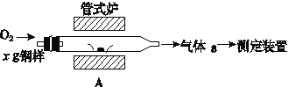
①氣體a的成分是__(填化學式)。
②若鋼樣中元素Z以FeZ的形式存在,在A中反應生成ZO2和穩定的黑色氧化物,則反應的化學方程式是___。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com