
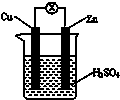
| A. | Zn是負極,發生還原反應 | |
| B. | 一段時間后,銅片質量減輕 | |
| C. | 電流從銅片經導線流向鋅片 | |
| D. | 一段時間后,電解質溶液的酸性保持不變 |
分析 原電池是把化學能轉變為電能的裝置,原電池放電時,較活潑的金屬作負極,較不活潑的金屬銅作正極,負極上鋅失電子發生氧化反應,正極上氫離子得電子發生還原反應,電子從負極沿導線流向正極.
解答 解:A、該原電池中,較活潑的金屬鋅作負極,負極上鋅失去電子發生氧化反應,故A錯誤;
B、原電池放電時,負極上鋅失電子生成鋅離子進入溶液,質量減輕,正極上氫離子得電子生成氫氣,所以銅片質量不變,故B錯誤;
C、原電池放電時,負極上失去電子發生氧化反應,正極上得電子發生還原反應,電子從負極沿導線流向正極,電流從正極沿導線流向負極鋅,故C正確;
D、原電池放電時,負極上失去電子發生氧化反應,正極上氫離子得電子生成氫氣,消耗氫離子,所以電解質溶液的酸性減弱,故D錯誤;
故選C.
點評 本題考查了原電池原理,根據原電池的定義、正負極上發生的電極反應、電子的流向和電流的流向分析解答即可,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 用待測液潤洗滴定用的錐形瓶 | |
| B. | 配制FeCl3溶液時,向溶液中加入少量Fe和稀鹽酸 | |
| C. | 用稀鹽酸洗滌盛放過石灰水的試劑瓶 | |
| D. | Na2CO3溶液保存在帶玻璃塞的試劑瓶中 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在標準狀況下,含4molHCl的濃鹽酸與足量的MnO2反應可生成22.4L氯氣 | |
| B. | 標準狀況下,2.24L H2O中含有H2O分子數為0.1NA | |
| C. | 1L 0.1mol/L NaHSO4溶液中含有的陽離子數目為0.1NA | |
| D. | 實驗室所制得的1.7g NH3中含有的電子數為NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應是焓減的反應 | |
| B. | 該反應是熵增的反應 | |
| C. | 降低溫度可使該反應自發進行 | |
| D. | 無論反應溫度是多少,該反應都不能自發進行 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
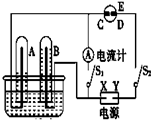 在如圖所示的實驗裝置中,E為一張用淀粉碘化鉀溶液潤濕的濾紙,C、D為夾在濾紙兩端的鉑夾,X、Y分別為直流電源的兩極.在A、B中充滿AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分別插入鉑電極.切斷電源開關S1,閉合開關S2,通直流電一段時間后,B電極質量增重,A極產生無色氣體.請回答下列問題:
在如圖所示的實驗裝置中,E為一張用淀粉碘化鉀溶液潤濕的濾紙,C、D為夾在濾紙兩端的鉑夾,X、Y分別為直流電源的兩極.在A、B中充滿AgNO3溶液后倒立于盛有AgNO3溶液的水槽中,再分別插入鉑電極.切斷電源開關S1,閉合開關S2,通直流電一段時間后,B電極質量增重,A極產生無色氣體.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe、Cu連接插在稀硫酸中形成的原電池,Fe為負極;那么Fe、Cu連接插在濃硝酸溶液中形成的原電池,Fe也為負極 | |
| B. | HBr的沸點比HCl高,那么HCl的沸點比HF高 | |
| C. | 硝酸銀溶液通常保存在棕色的試劑瓶中,是因為硝酸銀見光易分解,那么濃硝酸溶液也要保存在棕色試劑瓶中 | |
| D. | 鎂比鋁活潑,工業上用電解熔融氧化鋁制鋁,所以工業上也用電解熔融氧化鎂制鎂 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
 已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入適量氯氣,溶液中某些離子的物質的量變化如圖所示.則下列有關說法中正確的是( )
已知:2Fe2++Br2=2Fe3++2Br- 2Fe3++2I-=2Fe2++I2.向FeI2、FeBr2的混合溶液中通入適量氯氣,溶液中某些離子的物質的量變化如圖所示.則下列有關說法中正確的是( )| A. | 還原性:Fe2+>I->Br- | |
| B. | 當通入2molCl2時,溶液中已發生的離子反應可表示為:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| C. | 原混合溶液中FeBr2的物質的量為6mol | |
| D. | 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com