
分析 (1)分別計算出兩溶液中含有溶質的質量,然后根據質量分數的公式計算;
(2)先根據溶液的質量與密度的關系計算溶液的體積,再根據溶液的質量與質量分數求出溶質的質量,繼而求出溶質的物質的量,根據物質的量濃度公式求出溶液的物質的量濃度.
解答 解:(1)20.0g質量分數為15.0%的KNO3溶液中溶質的質量為:20.0g×15.0%=3.0g,
40.0g質量分數為30.0%的KNO3溶液中含有溶質的質量為:40.0g×30.0.0%=12.0g,
溶液混合前后溶質、溶液的質量都不變,所以混合液的質量分數為:$\frac{3.0g+12.0g}{20.0g+40.0g}$×100%=25%.
答:混合后溶液的質量分數為25%;
(2)混合液中溶質的質量為:3.0g+12.0g=15.0g,溶質的物質的量為:n=$\frac{15.0g}{101g/mol}$=$\frac{15}{101}$mol,
溶液的體積為V=$\frac{40g+20g}{1.2g/mL}$=500mL=0.5L,
所以溶液的物質的量濃度為:c=$\frac{\frac{15}{101}mol}{0.5L}$≈2.97mol/L,
答:混合后溶液的物質的量濃度為2.97 mol/L.
點評 本題考查了物質的量濃度、溶質的質量分數的計算,題目難度中等,注意物質的量濃度、溶質的質量分數計算方法,該題是高考中的常見考點和題型,試題基礎性強,側重對學生基礎知識的鞏固和訓練,旨在考查學生靈活運用基礎知識解決實際問題的能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
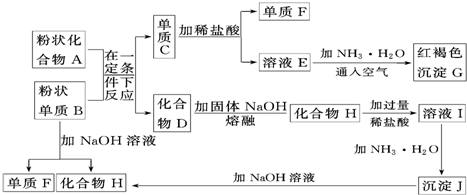
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | v(SO2)=4 mol/(L•min) | B. | v(O2)=2 mol/(L•min) | ||
| C. | v(SO2)=0.1 mol/(L•min) | D. | v(SO2)=0.1 mol/(L•s) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉著火可用水撲滅 | |
| B. | 鈉可從硫酸鎂溶液中置換出大量的鎂 | |
| C. | 自然界可存在少量的鈉單質 | |
| D. | 金屬鈉長期置于空氣中,最終變成Na2CO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
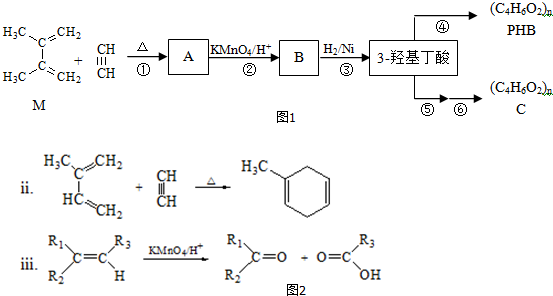
 .
. ;
;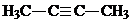 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com