
【題目】利用酸解法制鈦白粉產生的廢液[含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4],生產鐵紅和補血劑乳酸亞鐵。其生產步驟如下:

已知:TiOSO4可溶于水,在水中可以電離為TiO2+和SO42—。請回答:
(1)步驟①中分離硫酸亞鐵溶液和濾渣的操作中所用的玻璃儀器是___________,步驟②得到硫酸亞鐵晶體的操作為蒸發濃縮、______________。
(2)步驟④的離子方程式是_______________。
(3)步驟⑥必須控制一定的真空度,原因是有利于蒸發水以及_______。
(4)硫酸亞鐵在空氣中煅燒生成鐵紅和三氧化硫,該反應中氧化劑和還原劑的物質的量之比為________。
(5)用平衡移動的原理解釋步驟⑤中加乳酸能得到乳酸亞鐵的原因________。
(6)為測定步驟②中所得晶體中FeSO4·7H2O的質量分數,取晶體樣品a g,溶于稀硫酸配成100.00 mL溶液,取出20.00 mL溶液,用KMnO4溶液滴定(雜質與KMnO4不反應)。若消耗0.1000 molL-1KMnO4溶液20.00 mL,所得晶體中FeSO4·7H2O的質量分數為(用a表示)____________。
【答案】玻璃棒、燒杯、漏斗 冷卻結晶、過濾、洗滌、干燥 Fe2++2HCO3-=FeCO3↓+H2O+CO2↑ 防止Fe2+被氧化 1: 4 硫酸亞鐵在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),CO32-與乳酸反應濃度降低,平衡向右移動,使碳酸亞鐵溶解得到乳酸亞鐵溶液
Fe2+(aq)+ CO32-(aq),CO32-與乳酸反應濃度降低,平衡向右移動,使碳酸亞鐵溶解得到乳酸亞鐵溶液 ![]() ×100%
×100%
【解析】
廢液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,加鐵屑,Fe與H2SO4和少量Fe2(SO4)3反應生成FeSO4,TiOSO4水解生成TiO2xH2O,過濾,濾渣為TiO2xH2O、Fe,濾液為FeSO4;FeSO4溶液通過蒸發濃縮、冷卻結晶、過濾洗滌得到硫酸亞鐵晶體,脫水、煅燒得到氧化鐵;FeSO4溶液中加如碳酸氫銨,反應生成碳酸亞鐵沉淀、硫酸銨和二氧化碳,碳酸亞鐵沉淀加乳酸,碳酸亞鐵溶解生成乳酸亞鐵溶液和二氧化碳,乳酸亞鐵溶液通過蒸發濃縮、冷卻結晶、過濾洗滌得到乳酸亞鐵晶體。
(1)步驟①中分離硫酸亞鐵溶液和濾渣的操作為過濾,過濾用的儀器有玻璃棒、燒杯、漏斗;步驟②得到硫酸亞鐵晶體的操作為蒸發濃縮、冷卻結晶、過濾、洗滌、干燥,故答案為:玻璃棒、燒杯、漏斗;冷卻結晶、過濾、洗滌、干燥;
(2)步驟④的反應為FeSO4與如碳酸氫銨反應生成碳酸亞鐵沉淀、硫酸銨和二氧化碳,反應的離子方程式是Fe2++2HCO3-=FeCO3↓+H2O+CO2↑,故答案為:Fe2++2HCO3-=FeCO3↓+H2O+CO2↑;
(3)Fe2+具有還原性,步驟⑥必須控制一定的真空度,原因是有利于蒸發水以及隔絕空氣,防止Fe2+被氧化,故答案為:防止Fe2+被氧化;
(4)硫酸亞鐵在空氣中煅燒生成鐵紅和三氧化硫,反應的方程式為4FeSO4+ O2 ![]() 4SO3+ 2 Fe2O3,由化合價變化可知,氧化劑為O2和還原劑為FeSO4,由得失電子數目守恒可知氧化劑和還原劑的物質的量之比為1: 4,故答案為:1:4;
4SO3+ 2 Fe2O3,由化合價變化可知,氧化劑為O2和還原劑為FeSO4,由得失電子數目守恒可知氧化劑和還原劑的物質的量之比為1: 4,故答案為:1:4;
(5)硫酸亞鐵在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),加入乳酸,CO32-與乳酸反應,使CO32-濃度降低,平衡向右移動,使碳酸亞鐵溶解得到乳酸亞鐵溶液,故答案為:硫酸亞鐵在溶液中存在如下平衡FeCO3(s)
Fe2+(aq)+ CO32-(aq),加入乳酸,CO32-與乳酸反應,使CO32-濃度降低,平衡向右移動,使碳酸亞鐵溶解得到乳酸亞鐵溶液,故答案為:硫酸亞鐵在溶液中存在如下平衡FeCO3(s)![]() Fe2+(aq)+ CO32-(aq),CO32-與乳酸反應濃度降低,平衡向右移動,使碳酸亞鐵溶解得到乳酸亞鐵溶液;
Fe2+(aq)+ CO32-(aq),CO32-與乳酸反應濃度降低,平衡向右移動,使碳酸亞鐵溶解得到乳酸亞鐵溶液;
(6)亞鐵離子會被高錳酸鉀氧化為三價鐵離子,本身被還原為+2價的錳離子,根據得失電子守恒可知5FeSO4·7H2O—KMnO4,則依據消耗0.1000mol/LKMnO4溶液20.00mL可知FeSO4·7H2O的質量分數為![]() ×100% =
×100% =![]() ×100%,故答案為:
×100%,故答案為:![]() 。
。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】連二次硝酸(H2N2O2)是一種二元酸,可用于制N2O氣體。
(1)連二次硝酸中氮元素的化合價為_____________________。
(2)常溫下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1的H2N2O2溶液,測得溶液pH與NaOH溶液體積的關系如圖所示。
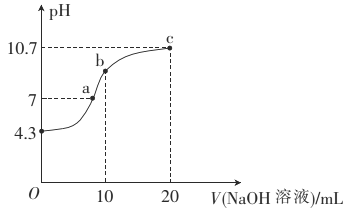
①寫出H2N2O2在水溶液中的電離方程式:______________。
②b點時溶液中c(H2N2O2)_____(填“>”、“<”或 “=”,下同)c(N2O22-)。
③a點時溶液中c(Na+)____c(HN2O2-)+c(N2O22-)。
(3)硝酸銀溶液和連二次硝酸鈉溶液混合,可以得到黃色的連二次硝酸銀沉淀,向該分散系中滴加硫酸鈉溶液,當白色沉淀和黃色沉淀共存時,分散系中![]() =______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
=______。[已知Ksp(Ag2N2O2)=4.2×10-9,Ksp(Ag2SO4)=1.4×10-5]
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】【化學-選修3:物質結構與性質】張亭棟研究小組受民間中醫啟發,發現As2O3(俗稱砒霜)對白血病有明顯的治療作用。氮(N)、磷(P)、砷(As)等都是VA族的元素,該族元素的化合物在研究和生產中有許多重要用途。回答下列問題:
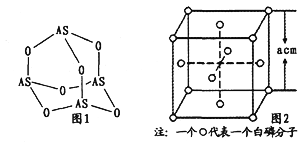
(1)N、P、As原子的第一電離能由大到小的順序為_______;As原子的核外電子排布式為______________。
(2)NH3的沸點比PH3_____(填“高"或“低”),原因是_____________。
(3)Na3AsO4中含有的化學鍵類型包括_______;AsO43-的空間構型為_______,As4O6的分子結構如圖1所示,則在該化合物中As的雜化方式是_________。
(4)白磷(P4)的晶體屬于分子晶體,其晶胞結構如圖2(小圓圈表示白磷分子)。己知晶胞的邊長為acm,阿伏加德羅常數為NAmol-1,則該晶胞中含有的P原子的個數為______,該晶體的密度為___g·cm-3(用含NA、a的式子表示)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅和鎂的合金2.3 g完全溶于濃HNO3,若反應中硝酸被還原只產生2.240 L的NO2氣體和168 mL的N2O4氣體(都已折算到標準狀況),在反應后的溶液中,加入足量的氫氧化鈉溶液,生產沉淀的質量為
A.4.1275 gB.4.255 gC.8.51 gD.9.62 g
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】對可逆反應4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列敘述正確的是
4NO(g)+6H2O(g),下列敘述正確的是
A.達到化學平衡時,4v正(O2) = 5v逆(NO)
B.若單位時間內生成x mol NO的同時,消耗x mol NH3,則反應達到平衡狀態
C.達到化學平衡時,若增加容器體積,則正反應速率減小,逆反應速率增大
D.化學反應速率關系是:2v正(NH3) = 3v正(H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(1)已知H2S的燃燒熱ΔH=-akJ·mol-1,寫出表示H2S燃燒反應的熱化學方程式__,表示H2S燃燒熱的熱化學方程式__。
(2)若將FeCl3溶液蒸干灼燒,最后得到的固體產物主要是__(填化學式)。FeCl3水溶液呈__(填“酸”、“中”、“堿”)性,原因為:__(用離子方程式表示)。
(3)炒過菜的鐵鍋未及時洗凈(殘液中有NaCl),第二天便會被腐蝕而出現紅褐色鐵銹,試回答:鐵鍋的腐蝕屬于電化腐蝕,其原因是__。此時鐵鍋銹蝕主要是吸氧腐蝕,電極反應方程式為:負極:__,正極__。
(4)估計下列各變化過程是熵增加還是熵減小。(用A、B、C填空)
NH4NO3爆炸:2NH4NO3(s)=2N2(g)+4H2O(g)+O2(g)__
水煤氣轉化:CO(g)+H2O(g)=CO2(g)+H2(g)__
臭氧的生成:3O2(g)=2O3(g)__
A.熵增大 B.熵減小 C.熵變很小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W是元素周期表前四周期中的常見元素,其相關信息如下表:
元素 | 相關信息 |
X | X原子的L層電子數是K層電子數的2倍 |
Y | Y原子的最外層電子排布式為:nsnnpn+2 |
Z | Z存在質量數為23,中子數為12的原子核 |
W | W有多種化合價,其白色氫氧化物在空氣中會迅速變成灰綠色,最后變成紅褐色 |
(1)W位于元素周期表第_____周期第______族,其原子最外層有____個電子。
(2)X的活潑性比Y的_____(填“強”或“弱”);X和Y的氣態氫化物中,較穩定的是____(寫化學式)。
(3)寫出Z2Y2的電子式________________,XY2的結構式__________________。
(4)在X原子與氫原子形成的多種分子中,有些分子的核磁共振氫譜顯示有兩種氫,寫出其中一種分子的名稱______________。氫元素、X、Y的原子也可共同形成多種分子和某種常見無機陰離子,寫出其中一種分子與該無機陰離子反應的離子方程式________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與我們的生活密切相關,請回答:
(1)在生活中要注意飲食平衡,蛋白質屬于_______(填序號,下同)食物,番茄屬于______食物;①酸性 ②堿性
(2)有四種常見藥物①阿司匹林、②青霉素、③胃舒平、④麻黃堿. 某同學胃酸過多,應該服用______(填序號,下同);從用藥安全角度考慮,使用前要進行皮膚敏感性測試的是_____;由于具有興奮作用,國際奧委會嚴禁運動員服用的是_________;
(3)蘋果汁是人們喜愛的飲品,由于其中含有Fe2+,現榨的蘋果汁在空氣中會由淺綠色變為棕黃色,若榨汁時加入維生素C,可有效防止這種現象發生.這說明維生素C具有________(填序號);①氧化性 ②還原性 ③堿性 ④酸性
(4)食用植物油進入人體后,在酶的作用下水解為高級脂肪酸和_________(寫名稱),進而被氧化成二氧化碳和水并提供能量,或作為合成人體所需其他物質的原料;
(5)硫酸亞鐵可用于治療缺鐵性貧血,某貧血患者每天須補充1.4g鐵元素,則服用的藥物中含硫酸亞鐵的質量至少為_________g;
(6)氨基酸是組成蛋白質的基本結構單元,其分子中一定含有的官能團是氨基(﹣NH2)和____(寫結構簡式或名稱).人體中共有二十多種氨基酸,其中人體自身________(填“能”或“不能”)合成的氨基酸稱為人體必需氨基酸;
(7)淀粉在淀粉酶的作用下最終水解為葡萄糖(C6H12O6),部分葡萄糖在體內被氧化生成二氧化碳和水.寫出葡萄糖在體內被氧化的化學方程式:________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】藥物嗎替麥考酚酯有強大的抑制淋巴細胞增殖的作用,可通過如下反應制得:
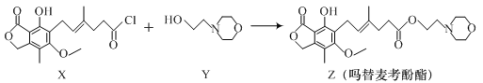 +HCl
+HCl
下列敘述正確的是
A.化合物X與溴水反應的產物中含有2個手性碳原子
B.化合物Y的分子式為C6H12NO2
C.1mol化合物Z最多可以與2molNaOH反應
D.化合物Z能與甲醛發生聚合反應
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com