
【題目】某混合物A,含有KAl(SO4)2、Al2O3和Fe2O3,在一定條件下可實現圖所示的物質之間的變化:

據此回答下列問題:
(1)I、II、III、IV四步操作采取的分離方法是___。
(2)根據上述框圖反應關系,寫出下列B、C、E所含物質的化學式
沉淀固體B___;C___;E___
(3)寫出①、④四個反應方程式(是離子反應的寫離子方程式)
①___;④___。
【答案】過濾 Al2O3 Al2O3,Fe2O3 K2SO4、(NH4)2SO4 Al2O3+2OH-=2AlO2-+H2O 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
混合物A含有KAl(SO4)2、Al2O3和Fe2O3,KAl(SO4)2可溶于水,加水過濾時,沉淀C為Al2O3和Fe2O3,溶液中的溶質為KAl(SO4)2;沉淀C中,Al2O3可與NaOH反應生成偏鋁酸鈉溶液,操作III為過濾,可得到Fe2O3沉淀和偏鋁酸鈉、NaOH的混合液;加入適量的鹽酸可得到氫氧化鋁沉淀和氯化鈉溶液,氫氧化鋁加熱得到氧化鋁,則固體B為氧化鋁;硫酸鋁鉀溶液通入過量的氨水得到氫氧化鋁沉淀和硫酸鉀銨溶液。
(1)根據流程可知,操作I、II、III、IV四步操作采取的分離方法均為過濾;
(2)固體B為氧化鋁,化學式為Al2O3;沉淀C為Al2O3、Fe2O3混合物;E為硫酸鉀和硫酸銨的混合物;
(3)反應為氧化鋁與NaOH反應生成偏鋁酸鈉和水,離子方程式為Al2O3+2OH-=2AlO2-+H2O;反應為氫氧化鋁受熱分解生成氧化鋁和水,化學方程式為2Al(OH)3![]() Al2O3+3H2O。
Al2O3+3H2O。


 永乾教育寒假作業快樂假期延邊人民出版社系列答案
永乾教育寒假作業快樂假期延邊人民出版社系列答案科目:高中化學 來源: 題型:
【題目】如圖所示為鈉硫高能電池的結構示意圖,M由Na2O和Al2O3制得,該電池的工作溫度為320℃左右,電池反應為2Na+xS=Na2Sx。下列說法不正確的是

A. 負極反應式為Na - e- = Na+
B. 放電時,消耗32 g正極活性物質,轉移的電子為2 mol
C. M的作用是導電和隔離鈉與硫
D. 消耗相同質量的負極活性物質,鈉硫電池的理論放電量是鉛蓄電池的4.5倍
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高鐵酸鉀是一種新型、高效、多功能水處理劑,工業上采用向KOH溶液中通入氯氣,然后再加入![]() 溶液的方法制備
溶液的方法制備![]() ,發生反應:
,發生反應:
①![]() (未配平);
(未配平);
②![]() 。
。
下列說法正確的是
A.若反應①中![]() ,則氧化劑與還原劑的物質的量之比為2:1
,則氧化劑與還原劑的物質的量之比為2:1
B.反應①中每消耗4 mol KOH,吸收標準狀況下![]()
C.氧化性:![]()
D.若反應①的氧化產物只有KClO,則得到![]() 時消耗
時消耗![]()
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氟及其化合物用途非常廣泛。回答下列問題:
(1)聚四氟乙烯商品名稱為“特氟龍”,可做不粘鍋涂層。它是一種準晶體,該晶體是一種無平移周期序、但有嚴格準周期位置序的獨特晶體。可通過____方法區分晶體、準晶體和非晶體。
(2)基態銻(Sb)原子價電子排布的軌道式為____。[H2F]+[SbF6]-(氟酸銻)是一種超強酸,存在[H2F]+,該離子的空間構型為______,依次寫出一種與[H2F]+具有相同空間構型和鍵合形式的分子和陰離子分別是_______、_________。
(3)硼酸(H3BO3)和四氟硼酸銨(NH4BF4)都有著重要的化工用途。
①H3BO3和NH4BF4涉及的四種元素中第二周期元素的第一電離能由大到小的順序_____(填元素符號)。
②H3BO3本身不能電離出H+,在水中易結合一個OH﹣生成[B(OH)4]﹣,而體現弱酸性。[B(OH)4]﹣中B原子的雜化類型為_____。
③NH4BF4(四氟硼酸銨)可用作鋁或銅焊接助熔劑、能腐蝕玻璃等。四氟硼酸銨中存在_______(填序號):
A.離子鍵 B.σ鍵 C.π鍵 D.配位鍵 E.范德華力
(4)某砷鎳合金的晶胞如圖所示,設阿伏加德羅常數的值為NA,該晶體的密度ρ=____g/cm3。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋁是一種重要金屬:
(1)生產中曾用鋁熱反應焊接鋼軌,則鋁與氧化鐵發生反應的化學方程式為:___。
(2)鋁還用于冶煉熔點較高的金屬如釩、鉻、錳等,請配平下列用鋁冶煉金屬釩的化學反應方程式:
___V2O5+___Al![]() ___Al2O3+___V
___Al2O3+___V
該反應中氧化劑是___,要得到1mol金屬釩,需要純鋁的質量___g。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是
A.MgO(s)+C(s)=CO(g)+Mg(g)高溫下能自發進行,則該反應ΔH>0、ΔS>0
B.常溫下等物質的量濃度的CH3COOH溶液和HCl溶液中,水的電離程度相同
C.0.1 mol·L-1 NH4Cl溶液加水稀釋,![]() 的值增大
的值增大
D.對于反應2SO2+O22SO3,使用催化劑能加快反應速率并提高SO2的平衡轉化率
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關同分異構體數目的敘述不正確的是
A.甲苯苯環上的一個氫原子被含3個碳原子的烷基取代,所得產物有6種
B.與![]() 互為同分異構體的芳香化合物有6種
互為同分異構體的芳香化合物有6種
C.C5H12的一氯代物有8種
D.菲的結構簡式為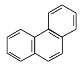 ,它與硝酸反應,可生成5種一硝基取代物
,它與硝酸反應,可生成5種一硝基取代物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】足量的銅和含有2.4×10-3mol硝酸的某濃硝酸完全反應,共收集到標準狀況下氣體體積22.4 mL。參加反應的銅的質量是( )
A. 38.4×10-3gB. 44.8×10-3gC. 48.3×10-3gD. 57.6×10-3g
查看答案和解析>>
科目:高中化學 來源: 題型:
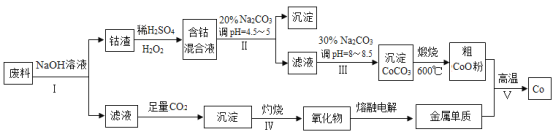
【題目】鈷(Co)及其化合物在工業上廣泛應用于磁性材料、電池材料及超硬材料等領域。某學習小組欲從某工業廢料中回收鈷,設計工藝流程如下:(廢料中含有Al、Co2O3 和Fe2O3等物質)。
請回答:
(1)廢料用NaOH溶液處理前通常先將廢料粉碎,其目的是____________。
(2)過程Ⅱ用稀H2SO4和H2O2溶液與Co2O3反應而達到浸出鈷的目的,請寫出該反應的離子方程式___________。在實驗室模擬工業生產時,也可用鹽酸浸出鈷,但實際工業生產中不用鹽酸,請分析不用鹽酸浸出鈷的主要原因______________。
(3)碳酸鈉溶液在過程Ⅱ和Ⅲ中所起作用有所不同,請寫出碳酸鈉在過程Ⅱ中發生反應生成沉淀的離子方程式__________________________________。
(4) 若在實驗室中完成過程Ⅳ,則沉淀物需在__________________(填儀器名稱)中灼燒;寫出在過程Ⅴ中發生反應的化學方程式__________________________________。
(5)將1.0×10-3 mol/LCoSO4與1.2×10-3mol/L的Na2CO3等體積混合,此時溶液中的Co2+的濃度為__________ mol/L。(已知:CoCO3的溶度積為:Ksp=1.0×10-13)
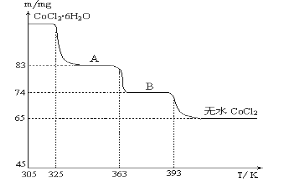
(6)CoO與鹽酸反應可得粉紅色的CoCl2溶液。CoCl2晶體因結晶水數目不同而呈現不同顏色,利用藍色的無水CoCl2吸水變色這一性質可制成變色水泥和顯隱墨水。如圖是粉紅色的CoCl2·6H2O晶體在烘箱中受熱分解時,剩余固體質量隨溫度變化的曲線,物質A的化學式是____________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com