

 .
.分析 本題為氯氣的制備和性質檢驗,裝置A為發生裝置,依據濃鹽酸的揮發性可知制取的氯氣中含有氯化氫和水蒸氣,依次通過洗氣瓶B、C除去氯化氫和水蒸氣,干燥的氯氣與鐵在D中發生氧化反應生成氯化鐵,氯氣有毒需要進行尾氣處理,F為吸收過量氯氣裝置.
(1)B處為氣體的凈化裝置,為洗氣瓶,應長進短出;
(2)依據濃鹽酸易揮發,制備的氯氣中含有氯化氫和水蒸氣,氯化氫易溶于水,氯氣在飽和食鹽水中溶解度很小,據此選擇飽和食鹽水除去氯化氫,依據濃硫酸具有吸水性,與氯氣不反應選擇濃硫酸干燥氯氣;
(3)鐵在氯氣中燃燒生成氯化鐵;
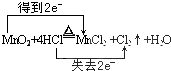
(4)在MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合價降低,1mol二氧化錳反應轉移2mole-,據此用雙線橋表示氧化還原反應電子轉移,依據方程式計算消耗二氧化錳、被氧化的氯化氫的物質的量;
解答 解:(1)B處為氣體的凈化裝置,為洗氣瓶,應長進短出;
故選:B;
(2)濃鹽酸易揮發,制備的氯氣中含有氯化氫和水蒸氣,氯化氫易溶于水,氯氣在飽和食鹽水中溶解度很小,所以可以用盛有飽和食鹽水的洗氣瓶除去氯化氫,濃硫酸具有吸水性,能夠干燥氯氣,除去氯氣中的水蒸氣;
故答案為:氯化氫;飽和食鹽水;水蒸氣;
(3)鐵在氯氣中燃燒生成氯化鐵,化學方程式:2Fe+3Cl2$\frac{\underline{\;點燃\;}}{\;}$2FeCl3;
故答案為:2Fe+3Cl2$\frac{\underline{\;點燃\;}}{\;}$2FeCl3;
(4)MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑中,Mn元素的化合價降低,氧化劑為MnO2,1mol二氧化錳反應轉移2mole-,用雙線橋法表示反應中電子轉移的數目為: ;
;
A中產生氯氣3.36L(標準狀況),物質的量為$\frac{3.36L}{22.4L/mol}$=0.15mol,
依據方程式可知:
MnO2+4HCl(濃)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+2H2O+Cl2↑
1 4 1
n(MnO2)n(HCl ) 0.15mol
解得消耗的二氧化錳的物質的量n(MnO2)=0.15mol;
消耗的氯化氫的物質的量n(HCl )=0.6mol,其中只有一半被氧化,則被氧化的HCl的物質的量0.3mol;
故答案為: ;0.15mol;0.3mol;
;0.15mol;0.3mol;
點評 本題考查了氯氣的制備及性質檢驗,明確氯氣制備原理和各裝置作用是解題關鍵,注意氧化還原反應基本概念,題目難度不大.


 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 1.0mol/L Na2CO3溶液:c(H2CO3)+c(HCO3-)+2 c(CO32-)=1.0mol/L | |
| B. | 1.0mol/L Na2CO3溶液:c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) | |
| C. | 向醋酸鈉溶液中加入適量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 向硝酸鈉溶液中滴加稀鹽酸得到的pH=5的混合溶液:c(Na+)=c(NO3-) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+、Na+、HCO3-、Cl- | B. | Fe3+、SCN-、Cl-、NO3- | ||
| C. | Mg2+、Cu2+、SO42-、NO3- | D. | Fe2+、SO42-、H+、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稀釋Na2CO3溶液時,C(HCO3-)、$\frac{C(O{H}^{-})}{C(C{{O}_{3}}^{2-})}$均增大 | |
| B. | 常溫下,反應4Fe(OH)2(s)+2H2O(I)+O2(g)=4Fe(OH)3(s)的△H<0,△S>0 | |
| C. | 用0.1mol•L-1CH3COOH溶液滴定0.1mol•L-1 NaOH至中性時:c(CH3COO-)+c(CH3COOH)>c(Na+) | |
| D. | 向純水中加入鹽酸或氫氧化鈉都能使水的電離平衡逆向移動,水的離子積減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 食鹽可作調味劑,也可用作食品防腐劑 | |
| B. | 二氧化硫可用于制作葡萄酒的食品添加劑 | |
| C. | 還原鐵粉和生石灰均可用作食品包裝袋內的脫氧劑 | |
| D. | “地溝油”禁止食用,但可用來制取肥皂 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 其它條件不變時,使用高效催化劑,不可以使NO的轉化率增大 | |
| B. | 平衡時,其它條件不變,充入NH3,平衡向右移動,NH3的轉化率增大 | |
| C. | 當混合氣體的密度不變了,則反應達到化學平衡狀態 | |
| D. | 平衡時,其它條件不變,升高溫度可使該反應的平衡常數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 全部 | B. | 除④⑥⑦以外 | C. | ③④⑤⑥ | D. | ②⑤⑥ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com