


科目:高中化學 來源: 題型:

| ||
| ||
2- 4 |
2- 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
(13分)已知NaHSO3溶液顯酸性,而Na2SO3溶液顯堿性。
(1)25℃時,在20.0mL0.5mol·L-1的NaOH溶液中,通入標準狀態(tài)下的224mLSO2,所得溶液顯______(填“酸”或“堿”)性,原因是_______________________________(用 化學用語表達),溶液中所含有的離子濃度由大到小的順序為____________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反應的離子方程式為____________________。當滴加NaClO至10mL時,溶液中由水電離的H+離子濃度為______________mol·L-1。滴加至20mL時溶液中離子濃度由大到小的順序為_________________________。
(3)若在(2)反應后的溶液中滴加少量甲基橙,溶液顯_________色。
查看答案和解析>>
科目:高中化學 來源:09~10學年浠水一中高二下學期期中考試化學卷 題型:填空題
(13分)已知NaHSO3溶液顯酸性,而Na2SO3溶液顯堿性。
(1)25℃時,在20.0mL0.5mol·L-1的NaOH溶液中,通入標準狀態(tài)下的224mLSO2,所得溶液顯______(填“酸”或“堿”)性,原因是_______________________________(用 化學用語表達),溶液中所含有的離子濃度由大到小的順序為____________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反應的離子方程式為____________________。當滴加NaClO至10mL時,溶液中由水電離的H+離子濃度為______________mol·L-1。滴加至20mL時溶液中離子濃度由大到小的順序為_________________________。
(3)若在(2)反應后的溶液中滴加少量甲基橙,溶液顯_________色。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年福建省廈門市畢業(yè)班適應性考試理綜化學試卷(解析版) 題型:填空題
(1)元素M是短周期元素,其常量存在于海水中,單質被譽為“國防金屬”。
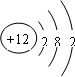
①M的原子結構示意圖為______。
②以M、Al為電極,KOH溶液為電解質溶液,則負極的電極反應式為______。
(2)淬火是將金屬工件加熱到某溫度,隨即浸入淬冷介質中快速冷卻的金屬熱處理工藝。
①使用水進行淬火,若生成磁性氧化鐵,該反應的化學方程式為____________
②驗證鐵用水淬火后的固體產物是否存在+3價的鐵,可選用的試劑為_______ (填序號)
A.H2O2溶液 B.銅粉 C.稀硫酸 D.KMnO4溶液
(3)髙鐵酸鉀在水中的反應為4FeO42—+10H2O 4Fe(OH)3+8OH—+3O2
4Fe(OH)3+8OH—+3O2
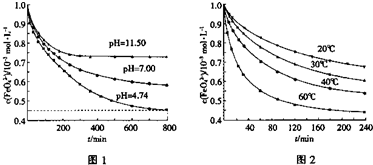
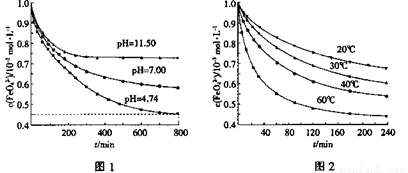
①圖1是25℃時K2FeO4在不同pH溶液中濃度的變化情況。pH =4.74時,反應從開始到800min的平均反應速率v(FeO42—)=______ (保留兩位有效數字)。
②圖1在800min后,三種溶液中K2FeO4的濃度均不再改變。觀察圖1判斷隨著pH 變大,此反應的平衡常數______(填“變大”、“變小”或“不變”)。
③圖2在240min后,四種溶液中K2FeO4的濃度均不再改變,則上述反應的反應熱 △H______0(填“>”、“<”、“=”)。
查看答案和解析>>
科目:高中化學 來源:09-10學年浠水一中高二下學期期中考試化學卷 題型:填空題
(13分)已知NaHSO3溶液顯酸性,而Na2SO3溶液顯堿性。
(1)25℃時,在20.0mL0.5mol·L-1的NaOH溶液中,通入標準狀態(tài)下的224mLSO2,所得溶液顯______(填“酸”或“堿”)性,原因是_______________________________(用 化學用語表達),溶液中所含有的離子濃度由大到小的順序為____________________。
(2)在上述溶液中逐滴加入1mol·L-1NaClO溶液至20mL,反應的離子方程式為____________________。當滴加NaClO至10mL時,溶液中由水電離的H+離子濃度為______________mol·L-1。滴加至20mL時溶液中離子濃度由大到小的順序為_________________________。
(3)若在(2)反應后的溶液中滴加少量甲基橙,溶液顯_________色。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com