
分析 自發氧化還原反應:2FeCl3+Cu=CuCl2+2FeCl2,能設計成原電池,Cu失電子化合價升高而作負極,則不如Cu活潑的金屬或導電的非金屬作正極,氯化鐵溶液為電解質溶液.
解答 解:該反應中,Cu元素化合價由0價變為+2價、Fe元素化合價由+3價變為+2價,所以Cu作負極,不如Cu活潑的金屬或導電的非金屬作正極,FeCl3溶液為電解質溶液,
可以選擇銀為正極,Y是硝酸銀溶液,該故答案為:電極上發生Y是硝酸銀溶液還原反應,電極方程式為2Fe3++2e-=2Fe2+,X即金屬銅為負極,電極方程式為Cu-2e-=Cu2+,裝置圖如下: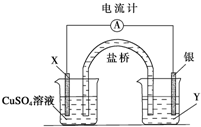 Y是硝酸銀溶液,X是金屬銅.
Y是硝酸銀溶液,X是金屬銅.
故答案為: Y是硝酸銀溶液,X是金屬銅.
Y是硝酸銀溶液,X是金屬銅.
點評 本題考查了原電池設計,根據方程式知元素化合價變化確定負極、電解質溶液,再結合金屬的活潑性、物質的導電性確定正極,根據金屬的活潑性強弱確定金屬的冶煉方法,題目難度不大.


科目:高中化學 來源: 題型:解答題
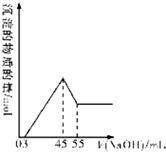 準確稱取10.0g鋁土礦樣品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反應后向濾液中加入10mol/L的NaOH溶液,產生沉淀的物質的量與加入NaOH溶液的體積關系如圖所示:
準確稱取10.0g鋁土礦樣品(含Al2O3、Fe2O3、SiO2),加入100mL硫酸溶液,充分反應后向濾液中加入10mol/L的NaOH溶液,產生沉淀的物質的量與加入NaOH溶液的體積關系如圖所示:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na2CO3 NaHCO3 NaCl NH4Cl | B. | NaHCO3 Na2CO3 NH4Cl NaCl. | ||
| C. | NH4Cl (NH4)2SO4 Na2S NaNO3 | D. | (NH4)2SO4 NH4Cl NaNO3 NaHCO3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 加入的物質 | 結論 | |
| A | 50mL 1mol/L H2SO4 | 反應結束后,c(Na+)=c(SO42-) |
| B | 0.5mol CaO | 若反應完全后溶液的體積仍為100mL,則溶液的pH約為14 |
| C | 50mL H2O | c(Na+)=2[c(CO32-)+c(HCO3-)] |
| D | 0.1mol NaHSO4 | 反應完全后,溶液pH減小,c (Na+)不變 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
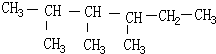 2,3,4-三甲基己烷,
2,3,4-三甲基己烷,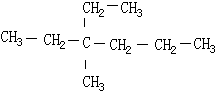 3-甲基-3-乙基己烷,
3-甲基-3-乙基己烷,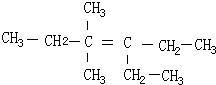 3,3-二甲基-4-乙基-3-己烯,
3,3-二甲基-4-乙基-3-己烯,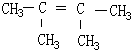 2,3-二甲基-2-丁烯.
2,3-二甲基-2-丁烯.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 洗滌的目的一般是除去沉淀或晶體表面可溶性的雜質,提高純度 | |
| B. | 洗滌的試劑一般可選用蒸餾水、冰水、乙醇、該物質的飽和溶液 | |
| C. | 洗滌的操作是向過濾器里的固體加洗滌劑,使洗滌劑浸沒固體,待洗滌劑自然流下 | |
| D. | 洗凈的檢驗是檢驗最后一次洗滌液中是否含有形成沉淀的該溶液中的離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 127I與131I互為同素異形體 | B. | 137Cs的核電荷數為137 | ||
| C. | 鈾235的中子數是143 | D. | 銫與水的反應比鈉與水的反應緩慢 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com