
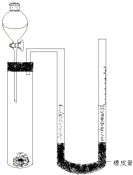
 在化學研究領域,經常需要對一些物質進行性質的確定.如利用下列裝置(夾持儀器已略去)測出一定質量鎂與鹽酸反應放出的氣體體積,對金屬鎂的相對原子質量進行測定,實驗步驟如下:
在化學研究領域,經常需要對一些物質進行性質的確定.如利用下列裝置(夾持儀器已略去)測出一定質量鎂與鹽酸反應放出的氣體體積,對金屬鎂的相對原子質量進行測定,實驗步驟如下:分析 (1)氣體會熱脹冷縮,且U型管內的液面差造成的壓強差會使氣體被壓縮;
(2)根據題意可知,mg鎂反應生成的氫氣的體積為(V2-V1)mL,從而可以求出氫氣的物質的量,然后根據1molMg~1molH2,從而可以求出mg鎂的物質的量,繼而能表示出鎂的相對原子質量Ar(Mg);由于鹽酸的加入能排出一部分氣體,故所收集到的氫氣的體積偏大;
(3)金屬鎂的密度比較小,和鹽酸劇烈反應時容易接觸到空氣,用銅網包裹可以確保鎂沉在鹽酸溶液的內部,從而鎂全部和鹽酸反應.
解答 解:(1)鎂和鹽酸的反應為放熱反應,故反應生成的氫氣開始時溫度偏高,故體積偏大,且u型管內的液面差造成的壓強差會使氣體被壓縮,故應等裝置冷卻至室溫后,再上下調節右邊玻璃管的高度,使兩端管內液面在同一水平面后再讀數,
故答案為:等裝置冷卻至室溫后,再上下調節右邊玻璃管的高度,使兩端管內液面在同一水平面;
(2)根據題意可知,mg鎂反應生成的氫氣的體積為(V2-V1)mL,故氫氣的物質的量為n=$\frac{({V}_{2}-{V}_{1})mL×1{0}^{-3}L/mL}{22.4L/mol}$=$\frac{{V}_{2}-{V}_{1}}{22400}$mol,而鎂和鹽酸反應時1molMg~1molH2,故可知mg鎂的物質的量n=$\frac{{V}_{2}-{V}_{1}}{22400}$mol,而摩爾質量M=$\frac{m}{n}$=$\frac{mg}{\frac{{V}_{2}-{V}_{1}}{22400}mol}$=$\frac{22400m}{{V}_{2}-{V}_{1}}$g/mol,故鎂的相對原子質量在數值Ar(Mg)=$\frac{22400m}{{V}_{2}-{V}_{1}}$;由于鹽酸的加入能排出一部分氣體,故所收集到的氫氣的體積偏大,故表達式不準確.故答案為:$\frac{22400m}{{V}_{2}-{V}_{1}}$;不;進入試管中的鹽酸的體積也計入了產生的氣體體積中;
(3)金屬鎂的密度比較小,和鹽酸劇烈反應時容易接觸到空氣而被氧氣氧化,用銅網包裹可以確保鎂沉在鹽酸溶液的內部,從而確保鎂全部和鹽酸反應生成氫氣,
故答案為:讓鎂條浸沒在鹽酸中,防止鎂與氧氣反應,使鎂全部用來產生氫氣.
點評 本題考查實驗探究,為高頻考點,側重考查學生實驗操作、實驗分析及評價,明確實驗原理及物質性質是解本題關鍵,注意誤差分析,為易錯題.


科目:高中化學 來源: 題型:選擇題
| A. | 溶液顏色保持不變,說明上述可逆反應達到平衡狀態 | |
| B. | 若用綠礬(FeSO4•7H2O)(M=278)作還原劑,處理1L廢水,至少需要917.4 g | |
| C. | 常溫下轉化反應的平衡常數K=l04,則轉化后所得溶液的pH=1 | |
| D. | 常溫下Ksp[Cr(OH)3]=1×10-32,要使處理后廢水中的c(Cr3+ )降至1×10-5mol/L,應調溶液的pH=5 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 第三周期元素的最高正化合價等于它所處的族序數 | |
| B. | 主族族序數與價電子數相同 | |
| C. | 非金屬元素在化合物中既可顯正價又可顯負價 | |
| D. | 所有非金屬元素的負化合價等于使原子達到8電子穩定結構所需得到的電子數 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
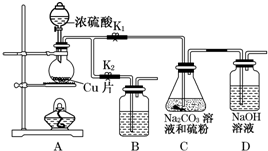
| 編號 | 1 | 2 | 3 | 4 |
| 溶液的體積/mL | 10.00 | 10.00 | 10.00 | 10.00 |
| 消耗I2標準溶液的體積/mL | 19.99 | 19.98 | 17.13 | 20.03 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
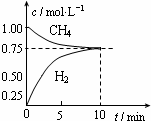 工業上制備合成氣的工藝主要是水蒸氣重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定條件下向體積為1L的密閉容器中充入1mol CH4和1mol H2O,測得CH4(g)和CO(g)的濃度隨時間變化曲線如圖所示,下列說法正確的是( )
工業上制備合成氣的工藝主要是水蒸氣重整甲烷:CH4(g)+H2O(g)?CO(g)+3H2(g);△H=+206kJ/mol,一定條件下向體積為1L的密閉容器中充入1mol CH4和1mol H2O,測得CH4(g)和CO(g)的濃度隨時間變化曲線如圖所示,下列說法正確的是( )| A. | 10min時用CH4表示的反應速率為0.075 mol•L-1•min-1 | |
| B. | 使用高效催化劑能夠增大CO的產率 | |
| C. | 該條件下反應的平衡常數為0.1875 | |
| D. | 升高溫度能使$\frac{c(C{H}_{4})}{c(CO)}$增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將銅屑加入Fe3+溶液中:2Fe3++Cu═2Fe2++Cu2+ | |
| B. | 將磁性氧化鐵溶于鹽酸:Fe3O4+8H+═3Fe3++4H2O | |
| C. | 氯化亞鐵溶液中通入氯氣:Fe2++Cl2═Fe3++2Cl- | |
| D. | 將鐵粉加入稀硫酸中:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com