
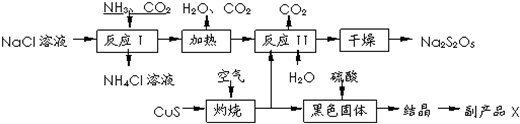
分析 反應Ⅰ為生成NaHCO3,加熱生成Na2CO3,在反應Ⅱ中二氧化硫與碳酸鈉反應生成NaHSO3與二氧化碳,加熱NaHSO3生成Na2S2O5,
(1)根據流程確定反應物為NaCl、NH3、CO2,產物為NH4Cl和碳酸氫鈉;
(2)CuS與氧氣反應生成黑色氧化銅和二氧化硫氣體,根據化學方程式可計算出轉移電子的物質的量;
(3)Na2S2O5中硫元素的化合價為+4價,生成二氧化硫化合價沒變;
(4)反應Ⅰ進行時應先通入氨氣,增大HCO3-的濃度,便于NaHCO3析出;氧化銅與硫酸反應生成硫酸銅,結晶得出硫酸銅晶體;根據流程圖可知,可循環使用的物質是二氧化碳;
(5)反應Ⅱ中反應應是二氧化硫與碳酸鈉反應生成NaHSO3,NaHSO3再生成Na2S2O5,反應方程式為Na2CO3+2 SO2+H2O=2NaHSO3+CO2,為了控制雜質,二氧化硫與碳酸氫鈉應按反應方程式中比例關系反應;檢驗產品中含有碳酸鈉雜質,需加酸反應檢驗二氧化碳生成,即用的澄清石灰水,但加酸會生成二氧化硫,二氧化硫也能使澄清石灰水變渾濁,故應先除去,用酸性高錳酸鉀溶液根據顏色不褪色確定二氧化硫除凈,據此答題.
解答 解:(1)流程確定反應物為NaCl、NH3、CO2,產物為NH4Cl和碳酸氫鈉,反應Ⅰ的化學方程式為:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,
故答案為:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl;
(2)硫化銅灼燒一定生成氧化銅和二氧化硫,反應的化學方程式為:2CuS+3O2$\frac{\underline{\;高溫\;}}{\;}$2CuO+2SO2,故答案為:2CuS+3O2$\frac{\underline{\;高溫\;}}{\;}$2CuO+2SO2;
(3)根椐提示可知生成二氧化硫和水,Na2S2O5與稀硫酸反應放出SO2和水,反應的離子方程式為:S2O52-+2H+=2SO2↑+H2O,
故答案為:S2O52-+2H+=2SO2↑+H2O;
(4)反應Ⅰ進行時應先通入氨氣,增大HCO3-的濃度,便于NaHCO3析出;上述分析可知,氧化銅與硫酸反應生成硫酸銅,蒸發濃縮,冷卻結晶,過濾洗滌,得出硫酸銅晶體,副產品X的化學式是CuSO4•5H2O,根據流程圖可知,可循環使用的物質是CO2,
故答案為:NH3;CuSO4•5H2O;CO2;
(5)從生產過程可以看出是硫酸銅晶體;從圖示中可以看出二氧化碳和水可以再次利用,反應Ⅱ中氣體與固體分別是二氧化硫和碳酸鈉,這兩種物質反應必須生成亞硫酸氫鈉:反應Ⅱ中反應應是二氧化硫與碳酸鈉反應生成NaHSO3,NaHSO3再生成Na2S2O5,反應方程式為Na2CO3+2SO2+H2O=2NaHSO3+CO2,因此氣體與固體的物質的量之比為2:1,檢驗產品中含有碳酸鈉雜質,需加酸反應檢驗二氧化碳生成,即用的澄清石灰水,但加酸會生成二氧化硫,二氧化硫也能使澄清石灰水變渾濁,故應先除去,用酸性高錳酸鉀溶液根據顏色不褪色確定二氧化硫除凈,故選①③⑥,
故答案為:2:1;①③⑥.
點評 本題考查了物質置制備的實驗方案分析,主要是物質性質的理解應用,離子方程式書寫方法,注意試劑的選擇和實驗操作的目的,掌握基礎是解題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 新制的氯水在光照下顏色逐漸變淺 | |
| B. | H2、I2、HI平衡混合氣縮小體積加壓后顏色變深 | |
| C. | 工業上生產硫酸的過程中,SO2在催化氧化時條件控制為常壓,而不是高壓 | |
| D. | 工業上合成氨氣時溫度選擇450℃左右,而不是常溫 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 可能含有Fe2+和Fe3+ | B. | 可能含有Fe2+和Cu2+ | ||
| C. | 可能含有Cu2+和Fe3+ | D. | 可能含有單質銅和Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
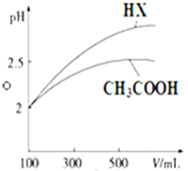 已知25℃時部分弱電解質的電離平衡常數數據如表所示:
已知25℃時部分弱電解質的電離平衡常數數據如表所示:| 化學式 | CH3COOH | H2CO3 | HClO | |
| 電離平衡常數 | Ka=1.8×10-5 | Kal=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 實驗室制乙酸乙酯時,不斷的蒸出乙酸乙酯來提高產率 | |
| B. | CO有毒,會與血液中血紅蛋白(用Hb表示)化合發生下述反應:CO+HbO2?HbCO+O2,輸氧搶救CO中毒的患者 | |
| C. | 皂化反應采用強堿性條件,促使油脂水解 | |
| D. | 合成氨時,采用高溫與高壓來提高氨氣的產率 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 汽車作為一種現代交通工具正在進入千家萬戶,汽車尾氣中含有CO、NO2等有毒氣體,其污染問題也成為當今社會急需解決的問題.
汽車作為一種現代交通工具正在進入千家萬戶,汽車尾氣中含有CO、NO2等有毒氣體,其污染問題也成為當今社會急需解決的問題.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
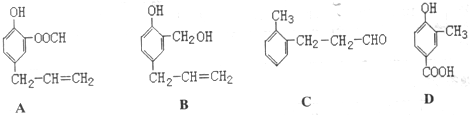
 .
.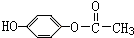 ;H:
;H: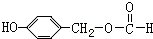 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com