
分析 (1)壓強越大反應速率越快,而反應①:CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g)正向氣體計量數減小,
反應②:CH3COOCH3(g)+C2H5OH(g)?CH3COOC2H5(g)+CH3OH(g)兩邊氣體計量數相等,反應③:C2H5OH(g)?CH3CHO(g)+H2(g)正向氣體計量數增加;
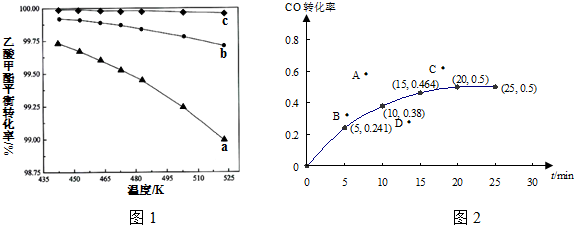
②溫度越高乙酸甲酯的平衡轉化率越小,所以平衡逆向移動,所以正反應是放熱反應;乙酸甲酯的轉化率越小,則氫碳比($\frac{n({H}_{2})}{n(乙酸甲酯)}$)越大;
(2)①CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.5 1
變化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$;壓強之比等于物質的量之比;
②若保持其它條件不變,起始時加入2mol CO和2mol H2,相當于在原平衡的基礎上加入一氧化碳的量,一氧化碳的轉化率減小;
(3)根據蓋斯定律解題;設燃料為1kg計算.
解答 解:(1)壓強越大反應速率越快,而反應①:CH3COOCH3(g)+2H2(g)?CH3OH(g)+C2H5OH(g)正向氣體計量數減小,所以平衡正向移動,
反應②:CH3COOCH3(g)+C2H5OH(g)?CH3COOC2H5(g)+CH3OH(g)兩邊氣體計量數相等,增大壓強平衡不移動,反應③:C2H5OH(g)?CH3CHO(g)+H2(g)正向氣體計量數增加,增大壓強平衡逆向移動,故答案為:增大壓強,也能提高反應速率.反應①為氣體分子數減小的反應,反應②氣體分子數不變,反應③為氣體分子數變大的反應,增大壓強反應①平衡正向移動,反應②平衡不移動,反應③平衡逆向移動,總結果,乙醇含量增大;
②溫度越高乙酸甲酯的平衡轉化率越小,所以平衡逆向移動,所以正反應是放熱反應,所以溫度升高K值減小;乙酸甲酯的轉化率越小,則氫碳比($\frac{n({H}_{2})}{n(乙酸甲酯)}$)越大,所以最大的是c,故答案為:變小; c;
(2)①CO(g)+2H2(g)?CH3OH(g)
起始量(mol/L) 0.5 1 0
變化量(mol/L) 0.25 0.5 0.25
平衡量(mol/L) 0.25 0.5 0.25
平衡常數K=$\frac{生成物平衡濃度冪次方乘積}{反應物平衡濃度冪次方乘積}$=$\frac{0.25}{0.25×0.{5}^{2}}$=4.0,$\frac{12.6}{3}=\frac{P}{3-0.38×2}$,所以P=9.4 MPa,故答案為:4.0;9.4 MPa;
②若保持其它條件不變,起始時加入2mol CO和2mol H2,相當于在原平衡的基礎上加入一氧化碳的量,一氧化碳的轉化率減小,所以點B符合,故答案為:B;
(3)①CH4(g)+H2O(1)?CO(g)+3H2 (g)△H=+250.1kJ.mol-l
②CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283.0kJ/mol
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H=-285.8kJ•mol-1
①+②+③×3得
CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;
設燃料為1kg,放出的能量為$\frac{1000}{16}$×890.3KJ×86.4%=4.8×107J;比能量為$\frac{4.8×1{0}^{7}J}{3.6×1{0}^{6}J}$,故答案為:CH4(g)+2O2(g)→CO2(g)+2H2O(l)△H=-890.3KJ/mol;$\frac{4.8×1{0}^{7}J}{3.6×1{0}^{6}J}$.
點評 本題綜合考查化學平衡的影響因素、CH4燃燒熱的熱化學方程式書寫、比能量的應用,主要考查蓋斯定律的應用,題目難度不大.


 期末寶典單元檢測分類復習卷系列答案
期末寶典單元檢測分類復習卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | “胃得樂”(主要成分為碳酸鎂)是一種抗酸藥) | |
| B. | 鴉片、嗎啡、海洛因等這些物質屬于毒品 | |
| C. | 青霉素能抑制細菌細胞壁的生長,致使細菌因細胞破裂而死亡 | |
| D. | “阿司匹林”是一種重要的抗生素 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a% | B. | 1-1.75% | C. | 4(l-a%)7 | D. | 3(l-a%)7 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.2mol•L-1 | B. | 0.15mol•L-1 | C. | 0.04mol•L-1 | D. | 0.4mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 氨催化氧化是硝酸工業的基礎,按要求回答下列問題:
氨催化氧化是硝酸工業的基礎,按要求回答下列問題:| 化學鍵 | N-H |  | O-H | O=O |
| E/(kJ•mol-1) | x | y | m | n |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  如圖反應達到平衡后,升高溫度,平衡向生成氨氣的方向移動 | |
| B. |  如圖表示鎂條放入鹽酸中生成氫氣的速率受溫度和濃度的影響 | |
| C. | 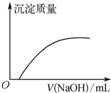 如圖表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的質量變化 | |
| D. | 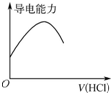 如圖表示向氨水中通入HCl氣體,溶液的導電能力變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 在一定溫度下,體積為2L的密閉容器中,NO2和N2O4之間發生反應:
在一定溫度下,體積為2L的密閉容器中,NO2和N2O4之間發生反應:查看答案和解析>>
科目:高中化學 來源: 題型:計算題
| t/s | 0 | 50 | 150 | 250 | 350 |
| 總壓強p/100kPa | 100 | 116 | 119 | 120 | 120 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 分散質粒子大小介于10-9 m~10-7m之間的分散系稱為膠體 | |
| B. | 電泳現象可證明膠體粒子帶有電荷 | |
| C. | 用聚光手電筒照射NaCl溶液和Fe(OH)3膠體時,產生的現象不相同 | |
| D. | 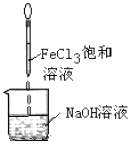 Fe(OH)3難溶于水,因此可以用如圖的方法制備Fe(OH)3膠體 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com