
| A. | +2 | B. | +3 | C. | +4 | D. | +6 |
 導學教程高中新課標系列答案
導學教程高中新課標系列答案科目:高中化學 來源: 題型:解答題
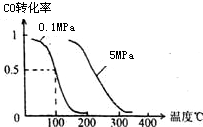 (1)在一定條件下,容積為 10L密閉容器中發生反應:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0
(1)在一定條件下,容積為 10L密閉容器中發生反應:CH4(g)+H2O(g)?CO(g)+3H2(g);△H>0查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
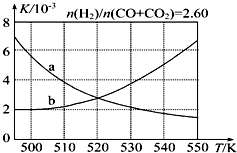 甲醇是重要的化工原料,又可作為燃料.利用合成氣(主要成分為CO、CO2和H2)在催化劑作用下合成甲醇,發生的主要反應如下:
甲醇是重要的化工原料,又可作為燃料.利用合成氣(主要成分為CO、CO2和H2)在催化劑作用下合成甲醇,發生的主要反應如下:| 化學鍵 | H-H | C-O | C≡O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 1 076 | 465 | 413 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c=$\frac{ρ•w}{M}$ | B. | c=$\frac{ρ•M}{w}$ | C. | c=$\frac{M}{m•V}$ | D. | c=$\frac{m}{M•V}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 150mL 0.5 mol/L MgCl2溶液 | B. | 100mL 1.0mol/L HCl溶液 | ||
| C. | 250mL 1.5mol/L NaCl溶液 | D. | 300 mL 0.25mol/L CaCl2溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
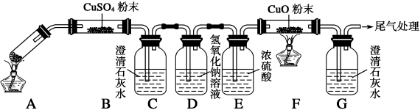
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com