

分析 Ⅰ.若W遇淀粉溶液變藍,w是碘單質,X和Y反應生成碘和Z,Z是生活中常用的調味品,Z是氯化鈉,根據元素守恒、氧化還原反應及X和W是單質、Y和Z為化合物知,X是氯氣,Y是碘化鈉;
Ⅱ.若X是工業上用量最大的金屬單質,則X是鐵,Z是一種具有磁性的黑色晶體,Z是四氧化三鐵,X、Y、Z、W四種物質有如下相互轉化關系,其中X、W單質,Y、Z為化合物,該反應是鐵和水蒸氣反應生成氫氣和四氧化三鐵,所以W是氫氣,Y是水.
(1)高溫下,鐵和水蒸氣反應生成四氧化三鐵和氫氣;
(2)①從實驗安全性方面分析;
②實驗過程中要防止雜質的干擾,在實驗中要有除雜裝置;
(3)先確定溶液中溶質成分,再根據原子守恒計算氫氧化鈉的體積.
解答 解:Ⅰ.若W遇淀粉溶液變藍,w是碘單質,X和Y反應生成碘和Z,Z是生活中常用的調味品,Z是氯化鈉,根據元素守恒、氧化還原反應及X和W是單質、Y和Z為化合物知,X是氯氣,Y是碘化鈉;
(1)通過以上分析知,向FeCl2溶液中加入Cl2的水溶液,使溶液顏色變為棕黃色,
故答案為:Cl2;
(2)工業上用電解飽和氯化鈉溶液制取氫氧化鈉,電解方程式為:2NaCl+2H2O $\frac{\underline{\;電解\;}}{\;}$ H2↑+Cl2↑+2NaOH,
故答案為:2NaCl+2H2O $\frac{\underline{\;電解\;}}{\;}$ H2↑+Cl2↑+2NaOH;
(3)氯氣有強氧化性,能把碘離子氧化生成碘酸根離子,同時自身被還原成氯離子,離子方程式為:3Cl2+I-+3H2O═6Cl-+IO3-+6H+,
故答案為:3Cl2+I-+3H2O═6Cl-+IO3-+6H+;
Ⅱ.若X是工業上用量最大的金屬單質,則X是鐵,Z是一種具有磁性的黑色晶體,Z是四氧化三鐵,X、Y、Z、W四種物質有如下相互轉化關系,其中X、W單質,Y、Z為化合物,該反應是鐵和水蒸氣反應生成氫氣和四氧化三鐵,所以W是氫氣,Y是水.
(1)高溫條件下,鐵和水反應生成四氧化三鐵和氫氣,反應方程式為3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$ Fe3O4+4H2,
故答案為:3Fe+4H2O$\frac{\underline{\;高溫\;}}{\;}$ Fe3O4+4H2;
(2)①氫氣還原氧化物的實驗中,因為氫氣和氧氣在一定范圍內會產生爆炸,所以實驗應該先制取氫氣,然后檢驗氫氣再通入氫氣,通入一段時間后再點燃酒精燈,所以實驗順序為b、c、a,
故答案為:b c a;
②該反應是放熱反應,鹽酸檢驗揮發性,所以制取的氫氣中含有氯化氫氣體,為防止氯化氫氣體干擾實驗,應該在甲、乙裝置中間增加一個裝有水的洗氣瓶,洗氣氯化氫氣體,
故答案為:在甲、乙裝置中間增加一個裝有水的洗氣瓶;
(3)四氧化三鐵和硝酸反應生成硝酸鹽和NO,向溶液中滴加氫氧化鈉溶液,硝酸鹽和氫氧化鈉反應生成沉淀和硝酸鈉,根據溶液中硝酸根離子的量計算氫氧化鈉的濃度,
硝酸的物質的量=4mol/L×0.05L=0.2mol,充分反應,產生112mL的NO,根據氮原子守恒,硝酸和一氧化氮的物質的量之比為1:1,則溶液中剩余硝酸的物質的量=0.2mol-$\frac{0.112L}{22.4L/mol}$=0.195mol,硝酸鹽和氫氧化鈉反應生成沉淀和硝酸鈉,則氫氧化鈉和硝酸根離子之間的物質的量之比為1:1,設氫氧化鈉的體積為V.
NaOH------NO3-,
1mol 1mol
2V 0.195mol
V=97.5mL,
故答案為:97.5.
點評 本題以元素化合物的推斷為載體考查了元素化合物的性質,明確元素化合物性質是解本題的關鍵,同時考查學生思維能力、分析推斷能力,注意(3)題中根據原子守恒計算氫氧化鈉的體積較簡便,正確確定溶質即可分析解答,難度較大.


 計算高手系列答案
計算高手系列答案科目:高中化學 來源: 題型:選擇題
 如圖所示某硅氧離子的空間結構示意圖(虛線不表示共價鍵).通過觀察分析,下列敘述正確的是( )
如圖所示某硅氧離子的空間結構示意圖(虛線不表示共價鍵).通過觀察分析,下列敘述正確的是( )| A. | 鍵角為120℃ | B. | 化學組成為SiO32- | ||
| C. | 鍵角為60° | D. | 化學組成為SiO44- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ls22s22p63s23p5 | B. | 1s22s22p63s23p2 | C. | 1s22s22p2 | D. | 1s22s22p63s23p4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | a-c=m-n | B. | b-d=m+n | C. | a>b>d>c | D. | b>a>c>d |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 Ⅰ.甲學生對Cl2與FeCl2和KSCN混合溶液的反應進行實驗探究.向A中通入氯氣至過量,觀察A中,發現溶液先呈紅色,然后變為黃色.
Ⅰ.甲學生對Cl2與FeCl2和KSCN混合溶液的反應進行實驗探究.向A中通入氯氣至過量,觀察A中,發現溶液先呈紅色,然后變為黃色. .甲同學猜想SCN-可能被Cl2氧化了,他進行了如下研究;
.甲同學猜想SCN-可能被Cl2氧化了,他進行了如下研究; ,偏堿性條件下,氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,該反應的離子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;
,偏堿性條件下,氰化鈉溶液的CN-被雙氧水氧化為HCO3-,同時放出NH3,該反應的離子方程式:CN-+H2O2+H2O═NH3↑+HCO3-;| 步驟:分別取等體積、等濃度的含氰廢水于甲、乙兩支試管中,再分別加入等體積、等濃度的雙氧水溶液,只向甲試管中加入少量的無水硫酸銅粉末,用離子色譜儀測定相同反應時間內兩支試管中的CN-濃度 | 現象與結論: 若甲試管中的CN-濃度小于乙試管中的CN-濃度,則Cu2+對雙氧水破氰反應起催化作用 若兩試管中的CN-濃度相同,則Cu2+對雙氧水破氰反應不起催化作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙炔是一種重要的有機化工原料,以乙炔為原料在不同的反應條件下可以轉化成以下化合物.
乙炔是一種重要的有機化工原料,以乙炔為原料在不同的反應條件下可以轉化成以下化合物. .
. 、
、 .
. ,試寫出有關化學反應方程式:CH≡CH+HCl$→_{△}^{催化劑}$CH2=CHCl,nCH2=CHCl$\stackrel{一定條件}{→}$
,試寫出有關化學反應方程式:CH≡CH+HCl$→_{△}^{催化劑}$CH2=CHCl,nCH2=CHCl$\stackrel{一定條件}{→}$ .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
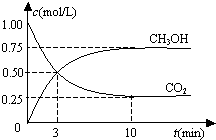 恒溫恒容密閉容器中充入1mol CO2和3mol H2,一定條件下發生反應:
恒溫恒容密閉容器中充入1mol CO2和3mol H2,一定條件下發生反應:| A. | 該密閉容器的體積為1 L | |
| B. | 反應達平衡,氫氣的轉化率為0.75 | |
| C. | 反應達平衡,氫氣平均反應速率0.075 mol/(L•min) | |
| D. | CO2或H2O物質的量不再改變時反應達平衡 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com