
| A、離子半徑大小:r(Y2-)>r(W3+) |
| B、W的氧化物對應的水化物可與Z的最高價氧化物水化物反應 |
| C、X有多種同素異形體,而Y不存在同素異形體 |
| D、X、M均能與氯形成由極性鍵構成的正四面體非極性分子 |


科目:高中化學 來源: 題型:
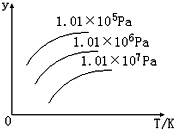 如圖表示溫度、壓強對下列平衡的影響:N2 (g)+3H2(g)?2NH3(g)△H<0圖中y軸表示的意義是( )
如圖表示溫度、壓強對下列平衡的影響:N2 (g)+3H2(g)?2NH3(g)△H<0圖中y軸表示的意義是( )| A、正反應速率 |
| B、平衡混合氣體中NH3的含量 |
| C、平衡混合氣體中N2的物質的量 |
| D、H2的轉化率 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、是吸熱反應 |
| B、是放熱反應 |
| C、是熵減少的反應 |
| D、熵增大效應大于焓變效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、反應中共轉移1.5mol 電子 |
| B、反應中共消耗鋅48.75克 |
| C、氣體A為H2和SO2的混合氣 |
| D、氣體A中H2與SO2的體積比為4:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、1L水中含有1molH2SO4 |
| B、溶液中含有1molH2SO4 |
| C、將98g濃硫酸溶于水配成1L溶液 |
| D、指1L硫酸溶液中含有98gH2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com