


| 1 |
| 8 |
| 1 |
| 2 |
| 1 |
| 4 |


科目:高中化學 來源: 題型:
| A、標準狀況下,22.4L己烷中共價鍵數目為18NA |
| B、常溫下,0.1mol乙烷與乙烯混合氣體中所含碳原子數為0.2NA |
| C、2.24L乙烯中所含σ鍵數為0.2NA |
| D、1mol苯分子中共有6NA原子共面 |
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
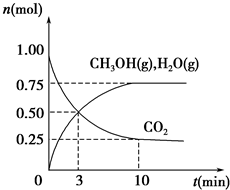 如何降低大氣中CO2的含量及有效地開發利用CO2是當前科學家研究的重要課題.
如何降低大氣中CO2的含量及有效地開發利用CO2是當前科學家研究的重要課題.溫度(K) CO2轉化率/(%)
| 500 | 600 | 700 | 800 | ||
| 1.5 | 45 | 33 | 20 | 12 | ||
| 2 | 60 | 43 | 28 | 15 | ||
| 3 | 83 | 62 | 37 | 22 |
| n(H2) |
| n(CO2) |
查看答案和解析>>
科目:高中化學 來源: 題型:
 反應CO(g)+H2O(g)?CO2(g)+H2(g)進行過程中的能量變化如圖所示.回答下列問題:
反應CO(g)+H2O(g)?CO2(g)+H2(g)進行過程中的能量變化如圖所示.回答下列問題:| 組別 | 溫度(℃) | 起始濃度(mol/L) | 反應達平衡時所需時間(min) | 平衡濃度(mol/L) c(CO2)或c(H2) | |
| c(CO) | c(H2O) | ||||
| Ⅰ | 800 | 1.00 | 1.00 | 10 | 0.50 |
| Ⅱ | 800 | 1.00 | 4.00 | t2 | c2 |
| Ⅲ | 800 | 1.00 | 1.00 | 1 | 0.50 |
| Ⅳ | 1000 | 1.00 | 1.00 | 8 | 0.40 |
| Ⅴ | 1000 | 2.00 | 2.00 | t5 | c5 |

查看答案和解析>>
科目:高中化學 來源: 題型:
 碳是化合物種類最多的元素,其單質及化合物是人類生產生活的主要能源物質.
碳是化合物種類最多的元素,其單質及化合物是人類生產生活的主要能源物質.| 1 |
| 2 |
查看答案和解析>>
科目:高中化學 來源: 題型:


查看答案和解析>>
科目:高中化學 來源: 題型:
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化學 來源: 題型:
| A、下列氧化物不都是酸性氧化物,如二氧化碳、二氧化氮;下列氧化物不都是堿性氧化物,如氧化鈉、過氧化鈉、氧化鋁 |
| B、分子是保存物質性質的一種微粒,且是化學變化中的最小微粒 |
| C、有些物質是由分子直接構成的,如二氧化碳、二氧化硅;有些物質是由原子直接構成,如金剛石、重晶石;有些是由離子直接構成的,如氯化銨 |
| D、使物質中化學鍵斷裂的變化一定是化學變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com