
| A. | 兩燒杯中參加反應的鋅粒等量 | |
| B. | 反應開始時產生H2的速率相等 | |
| C. | 反應開始后乙燒杯中的c(H+)始終比甲燒杯中的c(H+)大 | |
| D. | 甲燒杯中放入鋅的質量一定比乙燒杯中放入鋅的質量大 |
分析 強弱電解質的根本區別是電離程度,部分電離的電解質是弱電解質,要證明HA是弱電解質,只要證明HA部分電離即可,據此分析解答.
解答 解:A.生成等量的氫氣,說明轉移電子相等,則參加反應的鋅的質量相等,不能說明HA部分電離,則不能證明HA是弱電解質,故A錯誤;
B.反應速率與氫離子濃度成正比,開始時反應速率相等,說明氫離子濃度相等,但不能說明HA部分電離,則不能證明HA是弱電解質,故B錯誤;
C.反應開始后乙燒杯中的c(H+)始終比甲燒杯中的c(H+)大,說明反應開始后HA繼續電離,則HA存在電離平衡,為部分電離,所以能證明HA是弱電解質,故C正確;
D.HA的強弱與放入鋅的質量大小無關,所以不能證明HA是弱電解質,故D錯誤;
故選C.
點評 本題考查電解質強弱,為高頻考點,明確強弱電解質根本區別是解本題關鍵,側重考查學生對強弱電解質概念的理解和運用,題目難度不大.


 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:實驗題
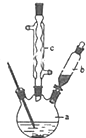 苯乙酸銅是合成優良催化劑、傳感材料--納米氧化銅的重要前驅之一.下面是它的一種實驗室合成路線:
苯乙酸銅是合成優良催化劑、傳感材料--納米氧化銅的重要前驅之一.下面是它的一種實驗室合成路線: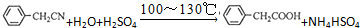

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在該條件下,反應前后的壓強之比為6:5.3 | |
| B. | 若反應開始時容器體積為2 L,則0~2 min內v(SO3)=0.35 mol/(L•min) | |
| C. | 在該條件下充入He氣,各物質的反應速率都將增大 | |
| D. | 若反應改為“恒溫恒容下”進行,放出Q kJ熱量需要的時間將大于2 min |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1mol/L Na2CO3溶液中的Na+ 數目為2NA | |
| B. | 標準狀況下,11.2L CCl4所含分子數為0.5NA | |
| C. | 各5.6 g鐵分別與足量的鹽酸、氯氣反應,電子轉移總數均為0.2NA | |
| D. | 1 mol Na與足量O2反應生成Na2O或Na2O2均失去NA電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 28g乙烯與丙烯的混合氣體中含有雙鍵數目為NA | |
| B. | 標準狀況下,22.4L甘油中含有羥基的數目為3NA | |
| C. | 1L0.1mol•L-1NaHS溶液中,HS-與S2-數目之和為0.1 NA | |
| D. | 0.2molCl2與0.1molCH4充分反應,生成HCl分子數為0.2 NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | AB2 | B. | A2B | C. | AB3 | D. | A3B |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 英國道爾頓----提出元素概念 | |
| B. | 法國拉瓦錫----提出原子學說 | |
| C. | 俄國門捷列夫---發現元素周期律 | |
| D. | 英國波義耳----建立燃燒現象的氧化學說 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、K+、SO42-、HCO3- | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、K+、SO42-、Cl- | D. | NH4+、K+、Cl-、NO3- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com