

分析 含鎳(Ni2+)廢液為原料生產NiOOH,在含Ni+的廢液中中加入碳酸鈉溶液,過濾得到NiCO3沉淀,沉淀中加入硫酸溶解生成NiSO4,加入試劑調節溶液的pH使鎳離子全部沉淀生成Ni(OH)2,在空氣中加熱Ni(OH)2制取NiOOH;
(1)確認Ni2+已經完全沉淀的實驗方法是取上層清液,加入碳酸鈉溶液觀察是否有沉淀生成,判斷鎳離子是否全部沉淀;
(2)依據溶度積常數計算溶液中氫氧根離子濃度,結合離子積常數計算溶液中的氫離子濃度,pH=-lgc(H+);
(3)空氣中加熱Ni(OH)2和空氣中氧氣反應生成NiOOH和水;
(4)消耗KMnO4物質的量:0.01 mol•L-1×0.02L=2×10-4 mol,
與NiOOH反應后剩余的Fe2+物質的量:2×10-4 mol×5×(200÷20)=0.01 mol,
Fe2+總物質的量:1.0 mol•L-1×0.1 L=0.1 mol,
與NiOOH反應的Fe2+的物質的量:0.1 mol-0.01 mol=0.09 mol,
得到n(NiOOH)=0.09 mol,計算得到NiOOH的質量,得到混合物中Ni(OH)2的質量,計算物質的量,依據xNiOOH•yNi(OH)2計算x和y的比值.
解答 解:(1)確認Ni2+已經完全沉淀的實驗方法是取上層清液,加入碳酸鈉溶液觀察是否有沉淀生成,判斷鎳離子是否全部沉淀,具體操作步驟為:靜置,在上層清液中繼續滴加1~2滴Na2CO3溶液,無沉淀生成;
故答案為:靜置,在上層清液中繼續滴加1~2滴Na2CO3溶液,無沉淀生成;
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中殘留c(Ni2+)≤2×10-5 mol•L-1,
Ksp[Ni(OH)2]=c(Ni2+)×c2(OH-)=2×10-15,c(OH-)=$\sqrt{\frac{2×1{0}^{-15}}{2×1{0}^{-5}}}$=10-5mol/L,c(H+)=$\frac{1{0}^{-14}}{1{0}^{-5}}$=10-9mol/L,則pH=9;
由于c(Ni2+)≤2×10-5 mol•L-1,則調節pH的范圍是:pH≥9,
故答案為:pH≥9;
(3)空氣中加熱Ni(OH)2和空氣中氧氣反應生成NiOOH和水,原子守恒配平書寫化學方程式為:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O,
故答案為:4Ni(OH)2+O2$\frac{\underline{\;\;△\;\;}}{\;}$4NiOOH+2H2O;
(4)消耗KMnO4物質的量:0.01 mol•L-1×0.02L=2×10-4 mol
與NiOOH反應后剩余的Fe2+物質的量:2×10-4 mol×5×(200÷20)=0.01 mol
Fe2+總物質的量:1.0 mol•L-1×0.1 L=0.1 mol
與NiOOH反應的Fe2+的物質的量:0.1 mol-0.01 mol=0.09 mol
n(NiOOH)=0.09 mol
m(NiOOH)=91.7 g•mol-1×0.09 mol=8.253 g
n[Ni(OH)2]=$\frac{9.18g-8.253g}{92.7g•mol-1}$=0.01mol,
x:y=n(NiOOH):n[Ni(OH)2]=0.09 mol:0.01 mol=9:1,
即x=9、y=1,
故答案為:9;1.
點評 本題考查了物質分離方法和實驗過程分析判斷、溶度積常數和離子積常數的計算應用,題目難度中等,明確實驗目的及化學實驗基本操作方法為解答關鍵,試題培養了學生的分析能力及化學實驗能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
| t/min | 2 | 4 | 7 | 9 |
| n(H2O)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖裝置中,容器甲內充入0.1mol NO氣體,干燥管內裝有一定量Na2O2,從A處緩慢通入CO2氣體.恒溫下,容器甲中活塞緩慢由D向左移動,當移至C處時容器體積縮小至最小,為原體積的$\frac{9}{10}$,干燥管中物質的質量增加2.24g隨著CO2的繼續通入,活塞又逐漸向右移動.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考慮活塞的摩擦)下列說法中正確的是( )
如圖裝置中,容器甲內充入0.1mol NO氣體,干燥管內裝有一定量Na2O2,從A處緩慢通入CO2氣體.恒溫下,容器甲中活塞緩慢由D向左移動,當移至C處時容器體積縮小至最小,為原體積的$\frac{9}{10}$,干燥管中物質的質量增加2.24g隨著CO2的繼續通入,活塞又逐漸向右移動.已知:2Na2O2+2CO2═2Na2CO3+O2 2NO+O2═2NO2 2NO2?N2O4(不考慮活塞的摩擦)下列說法中正確的是( )| A. | 活塞從D處移動到C處的過程中,通入CO2體積為2.24L(標準狀況) | |
| B. | NO2轉化為N2O4的轉換率為20% | |
| C. | 活塞移至C處后,繼續通入0.01mol CO2,此時活塞恰好回到D處 | |
| D. | 若改變干燥管中Na2O2的量,要通過調節甲容器的溫度及通入CO2的量,使活塞發生從D到C,又從C到D的移動,則Na2O2的質量應大于1.56g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 銀電極是負極 | B. | X電極是鋅電極 | ||
| C. | 去掉鹽橋電流計指針仍偏轉 | D. | Y溶液為AgNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 合成氨工業的核心反應是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量變化如圖所示,回答下列問題:
合成氨工業的核心反應是:N2(g)+3H2(g)?2NH3(g)△H=Q kJ•mol-1,能量變化如圖所示,回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2Cu2++2H2O$\frac{\underline{\;通電\;}}{\;}$2Cu+4H++O2↑ | B. | Cu2++2Cl-$\frac{\underline{\;通電\;}}{\;}$Cu+Cl2↑ | ||
| C. | 2Cl-+2H2O$\frac{\underline{\;通電\;}}{\;}$2OH-+H2↑+Cl2↑ | D. | 2H2O$\frac{\underline{\;通電\;}}{\;}$2H2↑+O2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水煤氣反應中,生成1molH2(g)吸收131.4 kJ熱量 | |
| B. | CO(g)+H2(g)?C(s)+H2O(g)△H=+131.4kJ•mol-1 | |
| C. | 水煤氣反應中生成1體積CO(g)吸收131.4 kJ熱量 | |
| D. | 反應物能量總和大于生成物能量總和 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

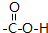 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 稱取8.0 g CuSO4,加入500 mL水 | |
| B. | 稱取7.68 g CuSO4,加入480 mL水 | |
| C. | 稱取12.5 g CuSO4•5H2O,加水配成500 mL溶液 | |
| D. | 稱取12.0 g CuSO4•5H2O,加水配成480 mL溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com