
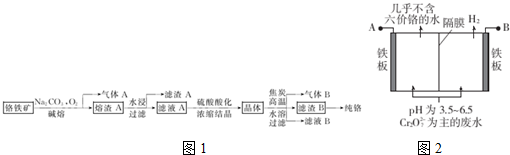
分析 鉻鐵礦組成為Fe0•Cr203或FeCr2O4,在碳酸鈉堿熔條件下與氧氣發生氧化還原反應,亞鐵離子被氧化成氧化鐵,同時生成Na2CrO4和CO2,所以氣體A為CO2,熔渣A為Fe203、Na2CrO4,熔渣A溶于水后過濾得濾渣A為Fe203,濾液A為Na2CrO4溶液,Na2CrO4溶液經硫酸酸化,再濃縮結晶得晶體Na2Cr2O7,與焦碳在高溫下氧化還原反應生成CO、氧化鉻和碳酸鈉,所以氣體B為CO,溶解再過濾可得濾渣B為Cr203,濾液B為Na2CO3溶液,生成的碳酸鈉可循環利用,含鉻廢水常采用電解法處理,耐酸電解槽用鐵板作陰、陽極,槽中盛放含鉻廢水,根據圖可知,與B相連的鐵板電極產生氫氣,所以該電極為陰極,該電極附近溶液酸性減弱,則與A相連的鐵板為陽極,在陽極上鐵放電產生亞鐵離子,亞鐵離子再還原Cr2O72-離子,根據電子得失守恒可判斷被還原的Cr2O72-的物質的量,據此答題;
解答 解:鉻鐵礦組成為Fe0•Cr203或FeCr2O4,在碳酸鈉堿熔條件下與氧氣發生氧化還原反應,亞鐵離子被氧化成氧化鐵,同時生成Na2CrO4和CO2,所以氣體A為CO2,熔渣A為Fe203、Na2CrO4,熔渣A溶于水后過濾得濾渣A為Fe203,濾液A為Na2CrO4溶液,Na2CrO4溶液經硫酸酸化,再濃縮結晶得晶體Na2Cr2O7,與焦碳在高溫下氧化還原反應生成CO、氧化鉻和碳酸鈉,所以氣體B為CO,溶解再過濾可得濾渣B為Cr203,濾液B為Na2CO3溶液,生成的碳酸鈉可循環利用,含鉻廢水常采用電解法處理,耐酸電解槽用鐵板作陰、陽極,槽中盛放含鉻廢水,根據圖可知,與B相連的鐵板電極產生氫氣,所以該電極為陰極,該電極附近溶液酸性減弱,則與A相連的鐵板為陽極,在陽極上鐵放電產生亞鐵離子,亞鐵離子再還原Cr2O72-離子,根據電子得失守恒可判斷被還原的Cr2O72-的物質的量,
(1)鉻鐵礦和焦炭在電爐中發生氧化還原反應,可以生成鉻、鐵和一氧化碳,反應的化學方程式為FeCr2O4+4C$\frac{\underline{\;高溫\;}}{\;}$Fe+2Cr+4CO↑,
故答案為:FeCr2O4+4C$\frac{\underline{\;高溫\;}}{\;}$Fe+2Cr+4CO↑;
(2)根據影響反應速率的因素可知,為加快鉻鐵礦的堿熔速率,可采取的措施有將鉻鐵礦粉碎、升高反應溫度、加速、適當增大氧氣濃度等,濾渣A為氧化鐵,其俗稱為鐵紅,根據上面的分析可知,鉻鐵礦氧化堿熔的化學方程式為4FeCr2O4+8Na2CO3+7O2$\frac{\underline{\;高溫\;}}{\;}$8Na2CrO4+8CO2+2Fe203,
故答案為:將鉻鐵礦粉碎、升高反應溫度、加速、適當增大氧氣濃度等;鐵紅;4FeCr2O4+8Na2CO3+7O2$\frac{\underline{\;高溫\;}}{\;}$8Na2CrO4+8CO2+2Fe203;
(3)根據上面的分析可知,晶體的主要成分的化學式為Na2Cr2O7,
故答案為:Na2Cr2O7;
(4)根據上面的分析可知,氣體B為 CO,根據流程圖可知,整個過程中可循環利用的一種物質是 Na2CO3,
故答案為:CO;Na2CO3;
(5)氧化鉻通過熱還原法獲得鉻,可以通過鋁熱反應得到,則此處適合用作還原劑的物質為金屬鋁,
故答案為:鋁;
(6)a.根據圖可知,與B相連的鐵板電極產生氫氣,所以該電極為陰極,該電極附近溶液酸性減弱,則與A相連的鐵板為陽極,所以A為電源正極,故a正確;
b.在陽極上鐵放電產生亞鐵離子,亞鐵離子再還原Cr2O72-離子,所以陽極區溶液中發生的氧化還原反應為Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,故b正確;
c.陰極上氫離子放電產生氫氣,所以陰極區附近溶液pH升高,故c錯誤;
d.當收集到H2 13.44L(標準狀況)即0.6mol時,根據電子守恒可知,能產亞鐵離子也是0.6mol,根據反應Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O可知,有0.1mol Cr2O72-被還原,故d正確;
故選abd.
點評 本題考查了物質制備流程和方案的分析判斷,物質性質的應用,題干信息的分析理解,操作步驟的注意問題和基本操作方法是解題關鍵,題目難度中等.


 尖子生新課堂課時作業系列答案
尖子生新課堂課時作業系列答案 英才計劃同步課時高效訓練系列答案
英才計劃同步課時高效訓練系列答案科目:高中化學 來源: 題型:選擇題
| A. | pH=7的溶液 | |
| B. | 氨水和硫酸銨的混合液中c(NH4+)=2c(SO42-) | |
| C. | c(H+)=10-7 mol•L-1的溶液 | |
| D. | $\frac{c({H}^{+})}{c(O{H}^{-})}$=10-14的溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1L2mol•L-1的(NH4)2S溶液中含有的S2-數目為0.2NA | |
| B. | 7.8g苯中含有C=C鍵數目為0.3NA | |
| C. | 常溫常壓下,5.6g乙烯和環丙烷的混合氣體中含有的碳原子數為0.4NA | |
| D. | 用惰性電極電解1L濃度均為2mol•L-1的AgNO3與Cu(NO3)2的混合溶液,當有0.2NA個電子轉移時,理論上陰極析出6.4g金屬 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯水應保存在棕色瓶中,久置的氯水,pH值減小 | |
| B. | 新制飽和氯水中存在4個平衡 | |
| C. | 在一定濃度的氯水中加小蘇打,$\frac{c(HClO)}{c(C{l}^{-})}$不變 | |
| D. | 飽和氯水與石灰石的反應是制取較濃HClO溶液的重要方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
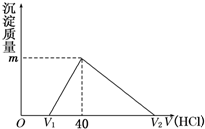 將一定量的鈉鋁合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的鹽酸滴定,沉淀質量與消耗鹽酸的體積關系如下圖所示,則下列選項正確的是( )
將一定量的鈉鋁合金置于水中,合金全部溶解,得到20mL pH=14的溶液,然后用1mol/L的鹽酸滴定,沉淀質量與消耗鹽酸的體積關系如下圖所示,則下列選項正確的是( )| A. | 圖中m值為1.56 g | B. | 標準狀況下產生氫氣896 mL | ||
| C. | 圖中V2為60 mL | D. | 原合金質量為0.92 g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50 s | B. | 30 s | C. | 5 s | D. | 1 s |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com