
| A. | 向0.1 mol/L、pH=1的NaHA溶液中加入NaOH溶液:H++OH-═H2O | |
| B. | 以金屬銀為陽極電解飽和NaCl溶液:2Cl-+2H2O$\frac{\underline{\;電解\;}}{\;}$ H2↑+Cl2↑+2OH- | |
| C. | 酸性條件下KIO3溶液與KI溶液發生反應生成I2:IO3-+5I-+3H2O═3I2+6OH- | |
| D. | NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
分析 A.0.1 mol/L、pH=1的NaHA溶液,可知為強酸的酸式鹽,完全電離;
B.銀為陽極,陽極上Ag失去電子,陰極氫離子得到電子;
C.酸性條件不能生成氫氧根離子;
D.使SO42-完全沉淀,以1:2反應,生成硫酸鋇、氫氧化鋁、一水合氨.
解答 解:A.0.1 mol/L、pH=1的NaHA溶液,可知為強酸的酸式鹽,完全電離,則加入NaOH溶液的離子反應為H++OH-═H2O,故A正確;
B.銀為陽極,陽極上Ag失去電子,陰極氫離子得到電子,則電解反應為2Ag+2H2O$\frac{\underline{\;電解\;}}{\;}$ H2↑+2AgOH↓,故B錯誤;
C.酸性條件不能生成氫氧根離子,則離子反應為IO3-+5I-+6H+═3I2+3H2O,故C錯誤;
D.使SO42-完全沉淀,以1:2反應,生成硫酸鋇、氫氧化鋁、一水合氨,離子反應為NH4++Al3++2SO42-+2Ba2++4OH-═Al(OH)3↓+2BaSO4↓+NH3.H2O,故D錯誤;
故選A.
點評 本題考查離子反應方程式的書寫,為高頻考點,把握發生的反應及離子反應的書寫方法為解答的關鍵,側重分析與應用能力的考查,注意電解及與量有關的離子反應,題目難度不大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
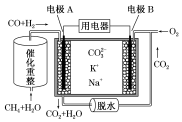
| A. | 反應CH4+H2O $\frac{\underline{\;催化劑\;}}{△}$3H2+CO,每消耗1mol CH4轉移6NA電子 | |
| B. | 電極A上H2參與的電極反應為H2+CO32--2e-=CO2+H2O | |
| C. | 電池工作時,CO32-向電極B移動 | |
| D. | 電極B上發生的電極反應為O2+2CO2+4e-=2CO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 阿伏伽德羅常數就是6.02×1023 | |
| B. | 1mol任何物質都約含有6.02×1023分子 | |
| C. | 3.01×1023 個Na+的物質的量是0.5 mol | |
| D. | 2molSO42-約含1.204×1024 SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3A2+B2═2A3B | B. | 3A2+2B2═2A3B2 | C. | A2+3B2═2AB3 | D. | 2A2+B2═2A2B |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧化物不可能是還原產物,只可能是氧化產物 | |
| B. | 飽和溶液一定比不飽和溶液的濃度大 | |
| C. | 有些化學反應不屬于化合、分解、置換、復分解中的任何一種反應 | |
| D. | 一種元素可能有多種氧化物,但同種元素的同種化合價只有一種氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗 | 現象 | 結論 |
| A | 將過量鐵粉加入稀硝酸中,充分反應后滴加KSCN溶液 | 有氣體生成,溶液呈血紅色 | 稀硝酸將Fe氧化為Fe3+ |
| B | 濃硫酸滴入蔗糖中,并攪拌 | 得黑色蓬松的固體并有刺激性氣味氣體 | 該過程中濃硫酸僅體現吸水性和脫水性 |
| C | 向FeCl2溶液中加入足量Na2O2粉末 | 出現紅褐色沉淀和無色氣體 | FeCl2溶液部分變質 |
| D | 向過量FeI2溶液中先滴加幾滴淀粉溶液,再滴加幾滴新制氯水 | 溶液變藍 | 還原性:I->Fe2+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com