
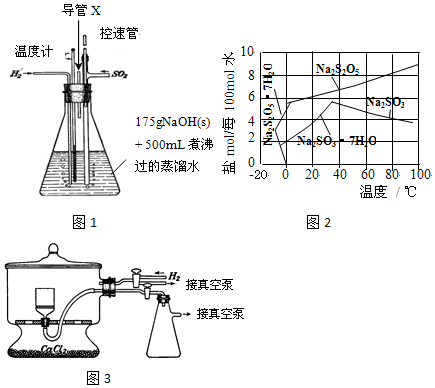
分析 (1)鋁和NaOH溶液反應生成偏鋁酸鈉和氫氣;
(2)該裝置中二氧化硫和氫氧化鈉發生反應,通入氫氣能防止亞硫酸鹽被氧化,如果錐形瓶內壓強過大會產生安全事故;
(3)SO2與NaOH溶液的反應是放熱反應導致溶液溫度升高;溫度小于100℃時要采用水浴加熱;
(4)根據圖知,溫度越高Na2S2O5溶解度增大,當接近40℃時亞硫酸鈉溶解度減小;控制“30℃左右”時,此時溶液中Na2SO3不飽和;
(5)焦亞硫酸鈉能被壓強氧化;真空干燥時,干燥室內部的壓力低,水分在低溫下就能氣化;
(6)④碘能使淀粉變藍色,所以可以用淀粉試液檢驗滴定終點;
⑤繼續做實驗為:繼續用標準Na2S2O3溶液滴定至藍色剛好褪去且半分鐘內顏色不復現,記錄滴定所消耗的體積.
解答 解:(1)鋁和NaOH溶液反應生成偏鋁酸鈉和氫氣,離子方程式為2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案為:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)該裝置中二氧化硫和氫氧化鈉發生反應,通入氫氣能防止亞硫酸鹽被氧化,如果錐形瓶內壓強過大會產生安全事故,所以導管的作用是排出H2、未反應的SO2及水蒸氣等,從而防止安全事故的發生,
故答案為:排出H2、未反應的SO2及水蒸氣等;
(3)SO2與NaOH溶液的反應是放熱反應導致溶液溫度升高,所以溶液“溫度迅速升高”;溫度小于100℃時要采用水浴加熱,需要的溫度是80℃,所以用水浴加熱;
故答案為:SO2與NaOH溶液的反應是放熱反應;80℃水浴加熱;
(4)根據圖知,溫度越高Na2S2O5溶解度增大,當接近40℃時亞硫酸鈉溶解度減小,所以要趁熱過濾;控制“30℃左右”時,此時溶液中Na2SO3不飽和,不析出,
故答案為:趁熱過濾;此時溶液中Na2SO3不飽和,不析出;
(5)焦亞硫酸鈉能被壓強氧化,則通入氫氣的目的是排出空氣,防止焦亞硫酸鈉被氧化;真空干燥時,干燥室內部的壓力低,水分在低溫下就能氣化,從而減少產品氧化,
故答案為:排出空氣,防止焦亞硫酸鈉被氧化;干燥室內部的壓力低,水分在低溫下就能氣化,減少產品氧化;
(6)④碘能使淀粉變藍色,所以可以用淀粉試液檢驗滴定終點,需要的操作是加入1~2mL淀粉溶液,
故答案為:加入1~2mL淀粉溶液;
⑤繼續做實驗為:繼續用標準Na2S2O3溶液滴定至藍色剛好褪去且半分鐘內顏色不復現,記錄滴定所消耗的體積,然后再重復實驗,減少實驗誤差,
故答案為:繼續用標準Na2S2O3溶液滴定至藍色剛好褪去且半分鐘內顏色不復現,記錄滴定所消耗的體積.
點評 本題考查制備實驗方案設計,為高頻考點,明確實驗原理及物質性質是解本題關鍵,側重考查學生實驗操作、實驗評價、物質制備能力,知道各個儀器的作用,題目難度中等.


科目:高中化學 來源: 題型:實驗題

查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 實驗室配制500mL、0.2mol/L的Na2SO4溶液,實驗操作步驟有:
實驗室配制500mL、0.2mol/L的Na2SO4溶液,實驗操作步驟有:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 膠體區別于其他分散系的本質特征是分散質的微粒直徑在10-9m~10-7m之間 | |
| B. | 用平行光照射NaCl溶液和Fe(OH)3膠體,可以加以區分 | |
| C. | 把FeCl3飽和溶液與NaOH溶液混合,以制取Fe(OH)3膠體 | |
| D. | 除去Fe(OH)3膠體中的H+、Cl-,可用滲析的實驗方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. |  =KCl+3Cl2↑+3H2O =KCl+3Cl2↑+3H2O | |
| B. | H2S+H2SO4(濃)═S↓+SO2↑+2H2O | |
| C. | 2H2S+SO2═3S↓+2H2O中氧化劑與還原劑的物質的量之比是1:2 | |
| D. | 3NO2+H2O═2HNO3+NO中氧化劑與還原劑的物質的量之比是1:1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;其2p能級的軌道有3個伸展方向,電子云的形狀為紡錘形.
;其2p能級的軌道有3個伸展方向,電子云的形狀為紡錘形.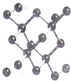
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com