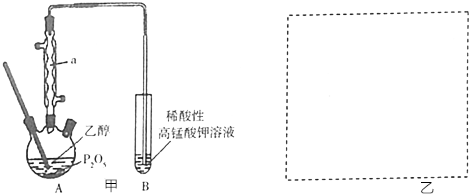
18.焦亞硫酸鈉(Na
2S
2O
5)在食品加工中常用作防腐劑、漂白劑和疏松劑.焦亞硫酸鈉為黃色結晶粉末,150℃時開始分解,在水溶液或含有結晶水時更易被空氣氧化.實驗室制備焦亞硫酸鈉過程中依次包含以下幾步反應:
2NaOH+SO
2═Na
2SO
3+H
2O …(a)
Na
2SO
3+H
2O+SO
2═2NaHSO
3…(b)
2NaHSO
3$\frac{\underline{\;\;△\;\;}}{\;}$Na
2S
2O
5+H
2O …(c)
實驗裝置如圖:
(1)實驗室可用廢鋁絲與NaOH溶液反應制取H
2,制取H
2的離子方程式為2Al+2OH
-+2H
2O=2AlO
2-+3H
2↑.
(2)如圖1裝置中,導管X的作用是排出H
2、未反應的SO
2及水蒸氣等.
(3)通氫氣一段時間后,以恒定速率通入SO
2,開始的一段時間溶液溫度迅速升高,隨后溫度緩慢變化,溶液開始逐漸變黃.“溫度迅速升高”的原因為SO
2與NaOH溶液的反應是放熱反應;實驗后期須保持溫度在約80℃,可采用的加熱方式為80℃水浴加熱.
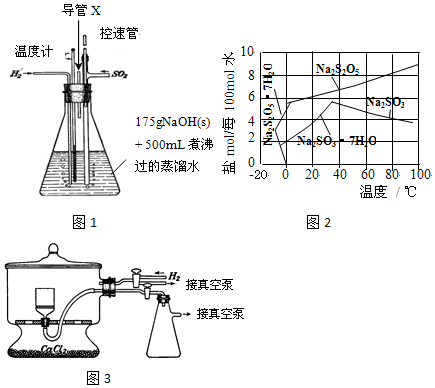
(4)反應后的體系中有少量白色亞硫酸鈉析出,參照題如圖2溶解度曲線,除去其中亞硫酸鈉固體的方法是趁熱過濾;然后獲得較純的無水Na
2S
2O
5應將溶液冷卻到30℃左右抽濾,控制“30℃左右”的理由是此時溶液中Na
2SO
3不飽和,不析出.
(5)用如圖3裝置干燥Na
2S
2O
5晶體時,通入H
2的目的是排出空氣,防止焦亞硫酸鈉被氧化;真空干燥的優點是干燥室內部的壓力低,水分在低溫下就能氣化,減少產品氧化.
(6)測定產品中焦亞硫酸鈉的質量分數常用剩余碘量法.已知:S
2O
52-+2I
2+3H
2O═2SO
42-+4I
-+6H
+;2S
2O
32-+I
2═S
4O
62-+2I
-請補充實驗步驟(可提供的試劑有:焦亞硫酸鈉樣品、標準碘溶液、淀粉溶液、酚酞溶液、標準Na
2S
2O
3溶液及蒸餾水).
①精確稱取產品0.2000g放入碘量瓶(帶磨口塞的錐形瓶)中.
②準確移取一定體積和已知濃度的標準碘溶液(過量)并記錄數據,在暗處放置5min,然后加入5mL冰醋酸及適量的蒸餾水.
③用標準Na
2S
2O
3溶液滴定至接近終點.
④加入1~2mL淀粉溶液.
⑤繼續用標準Na
2S
2O
3溶液滴定至藍色剛好褪去且半分鐘內顏色不復現,記錄滴定所消耗的體積.
⑥重復步驟①~⑤;根據相關記錄數據計算出平均值.

 閱讀快車系列答案
閱讀快車系列答案
 .
.