
分析 氧化還原反應中得電子化合價降低的反應物是氧化劑,失電子化合價升高的反應物是還原劑,還原劑對應的產物是氧化產物,根據元素化合價變化標出電子轉移的方向和數目,由此分析解答.
解答 解:該反應中,硝酸得電子作氧化劑,銅失電子作還原劑,銅對應的產物硝酸銅是氧化產物,該反應中銅失去電子數=3(2-0)=6,硝酸得電子數=2(5-2)=6,所以用雙線橋法在化學方程式中表示出電子轉移的方向和數目為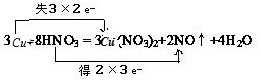 ,
,
(1)被氧化的元素是銅,被還原的元素是氮,故答案為:銅;氮;
(2)氧化劑是硝酸,還原劑是銅,故答案為:硝酸;銅;
(3)銅發生氧化反應,硝酸發生還原反應,故答案為:銅;硝酸;
(4)若有5.6L(標準狀況)NO的物質的量為:$\frac{5.6L}{22.4L/mol}$=0.25mol,生成1mol的一氧化氮轉移3mol的電子,則轉移的電子物質的量是0.75mol,被還原的硝酸為0.25mol,故答案為:0.75;0.25.
點評 本題考查氧化還原反應,為高考常見題型,側重于學生的分析能力和計算能力的考查,注意從化合價的角度及電子守恒角度解答該題,難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 人體缺乏鐵元素,可以補充硫酸亞鐵,且多多益善 | |
| B. | 古代鍍金(鎏金)工藝,利用了電鍍原理 | |
| C. | 反復煮沸的水含有較多的亞硝酸鹽,對人體有害 | |
| D. | 護膚品中含有的甘油具有美白作用 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氯氣溶于水:Cl2+H2O=2H++C1-+C1O- | |
| B. | 硫酸鋁溶液中加入足量氨水:Al3++4OH-=AlO2-+2H2O | |
| C. | FeS04溶液與稀硝酸反應:3Fe2++NO3-+4H+=3Fe3++NO+2H2O | |
| D. | 稀硫酸中加入鐵粉:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Mg3N2晶體中的化學鍵是共價鍵 | |
| B. | 某物質含有離子鍵,則該物質在任何條件下均能導電 | |
| C. | 干冰是分子晶體,其氣化過程中只需克服分子間作用力 | |
| D. | 常溫常壓下,氣態單質分子中,每個原子的最外層都具有8電子穩定結構 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 陽離子 | NH4+、Mg2+ |
| 陰離子 | Cl-、CO32-、SO42-、NO3- |
| 序號 | 實驗內容 | 實驗現象 |
| Ⅰ | 向該溶液中加入足量Ba(OH)2溶液并加熱 | 產生6.27g白色沉淀并放出1.12L有刺激性氣味的氣體 |
| Ⅱ | 將Ⅰ得到的沉淀中滴加足量的稀鹽酸 | 有氣體放出,沉淀變為2.33g |
| Ⅲ | 向Ⅱ反應后的濾液中滴加AgNO3溶液 | 有白色沉淀產生 |
| 陰離子 | NH4+ | Mg2+ | CO32- | SO42- |
| c/mol•L-1 | 0.5mol/L | × | 0.2mol/L | 0.1mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1mol/L的蔗糖溶液 | B. | 0.1mol/L的CaCl2溶液 | ||
| C. | 0.2mol/L的NaCl溶液 | D. | 0.1mol/L的鹽酸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 自然界的硫元素主要以硫單質、硫化物和硫酸鹽等形式存在 | |
| B. | 濃硫酸可作干燥劑,但不能干燥二氧化硫、氯氣等氣體 | |
| C. | 二氧化硫能使溴水褪色,說明其具有漂白性 | |
| D. | 濃硫酸中存在的主要是硫酸分子,常溫下就能和銅片劇烈反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ②④⑤⑦ | B. | ⑥ | C. | ⑥⑦ | D. | ⑤⑥⑧ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 9.0g草酸中共用電子對數目為0.9NA | |
| B. | 9.0 g草酸被NaClO氧化生成CO2,轉移的電子數為0.2 NA | |
| C. | 9.0 g草酸溶于水,其中C2O42-和HC2O4-的微粒數之和為0.1NA | |
| D. | 9.0g草酸受熱完全分解為CO2、CO、H2O,標況下測得生成的氣體體積為4.48 L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com