

 .
.分析 堿性溶液能使濕潤的紅色石蕊試紙變藍,取45.6g X加熱到150℃時,發生非氧化還原反應,生成氣體A和固體化合物B,收集到的氣體A能使濕潤的pH試紙顯藍色為氨氣,根據氮原子守恒計算出45.6g X中氮原子的物質的量;乙醛和新制氫氧化銅發生氧化還原反應生成乙酸鈉、氧化亞銅和水,把得到的B全部溶于水,均分為二份,實驗過程二,磚紅色沉淀D為氧化亞銅,氧化亞銅和稀硫酸反應可生成硫酸銅和銅,加稀硫酸和氧化亞銅發生氧化還原反應,紅色沉淀為F為銅,藍色溶液E為硫酸銅,據此分析解答.
解答 解:氣體能使濕潤的紅色石蕊試紙變藍,則氣體的水溶液顯堿性,則A為氨氣,45.6g X加熱到150℃時,發生非氧化還原反應,生成氣體A的體積為17.92L(已折合為標準狀況),物質的量為:n(NH3)=$\frac{17.92L}{22.4mol/L}$=0.8mol,把得到的B全部溶于水,均分為二份,加熱氯化鋇,發生:SO42-+Ba2+═BaSO4↓,白色沉淀E為BaSO4,n(SO42-)=n(BaSO4)=$\frac{23.3g}{233g/mol}$=0.1mol,45.6g X中n(SO42-)=0.2mol,在加熱條件下,乙醛和新制氫氧化銅發生氧化還原反應生成乙酸、氧化亞銅和水,反應方程式為:CH3CHO+2Cu(OH)2+NaOH$\stackrel{△}{→}$CH3COONa+Cu2O↓+3H2O,把得到的B全部溶于水,均分為二份,實驗過程二,加入過量的氫氧化鈉溶液溶液呈堿性,加入乙醛溶液加熱,得到磚紅色沉淀D7.2g,為乙醛與氫氧化銅發生氧化還原反應生成氧化亞銅沉淀,n(Cu2O)=$\frac{7.2g}{144g/mol}$=0.05mol,45.6g X中n(Cu)=0.05×4mol=0.2mol,磚紅色沉淀D為氧化亞銅,加稀硫酸,發生反應Cu2O+H2SO4=CuS04+Cu↓+H2O紅色沉淀為F為銅,藍色溶液E為硫酸銅,
(1)氣體A為氨氣,氨氣為共價化合物,氨氣中存在3個氮氫鍵,氮原子最外層達到8電子穩定結構,氨氣的電子式為 ,
,
故答案為: ;
;
(2)45.6g X中n(SO42-)=0.2mol,n(Cu)=0.05×4mol=0.2mol,n(NH3)=$\frac{17.92L}{22.4mol/L}$=0.8mol,根據質量守恒:0.2mol×96g/mol+0.2mol×64g/mol+0.8mol×17g/mol=45.6g,則鹽X的化學式為Cu(NH3)4SO4,X在150℃條件下分解的化學方程式為:Cu(NH3)4SO4$\frac{\underline{\;150℃\;}}{\;}$CuSO4+4NH3↑,
故答案為:Cu(NH3)4SO4;Cu(NH3)4SO4$\frac{\underline{\;150℃\;}}{\;}$CuSO4+4NH3↑;
(3)氧化亞銅和稀硫酸反應可生成硫酸銅和銅,紅色沉淀為F為銅,銅和稀硝酸反應生成硝酸銅、一氧化氮和水,反應的離子方程式為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O,
故答案為:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;
(4)磚紅色沉淀D為氧化亞銅,D與FeCl3溶液(加過量鹽酸)混合反應,酸性條件下:Cu2O+2H+=Cu2++Cu↓+H2O,FeCl3具有氧化性,能氧化Cu生成氯化銅,同時自身被還原生成氯化亞鐵,離子方程式為2Fe3++Cu=2Fe2++Cu 2+,鐵離子有可能剩余,所以反應后溶液存在的陽離子有:Fe2+、Cu2+、H+或Fe2+、Cu2+、H+、Fe3+,
故答案為:Fe2+、Cu2+、H+或Fe2+、Cu2+、H+、Fe3+.
點評 本題考查了物質組成的推斷,涉及離子的檢驗、物質的性質等知識點,熟悉元素化合物的性質、知道流程圖中每一步發生的反應及反應現象是解本題關鍵,題目難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 若向該溶液中加入過量的稀硫酸和KSCN溶液,溶液顯血紅色 | |
| B. | 若向該溶液中加入過量的稀硫酸,產生的氣體遇空氣能變成紅棕色 | |
| C. | 該溶液中所含的離子是:Fe2+、Na+、SO42-、NO3- | |
| D. | 若向該溶液中加入足量的NaOH溶液,充分反應后,過濾、洗滌、灼燒,最終所得固體的質量為72g |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 滴定次數 | 待測溶液的體積/mL | 標準溶液的體積 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| T/℃ | 30 | 40 | 50 |
| 生成 NH3量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
| 溫度/℃ | 1000 | 1150 | 1300 |
| 平衡常數 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (C6H10O5)n可以是淀粉或纖維素,二者均屬于多糖,互為同分異構體 | |
| B. | 酸性高錳酸鉀溶液可將乙醇氧化為乙酸,將燒黑的銅絲趁熱插入乙醇中也可得到乙酸 | |
| C. | 可以利用銀鏡反應證明反應①的最終產物為葡萄糖 | |
| D. | 向反應②得到的混合物中倒入飽和氫氧化鈉溶液并分液可得到純凈的乙酸乙酯 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 羥基的電子式: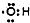 | |
| B. | 苯的分子式: | |
| C. | 原子核內有10個中子的氧原子:${\;}_{8}^{18}$O | |
| D. | 甲烷分子的比例模型: |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 往硫化氫水溶液中加堿有利于S2-的增加 | |
| B. | 加入催化劑有利于氨氧化的反應 | |
| C. | 高壓不利于合成氨的反應 | |
| D. | 500℃左右比室溫更有利于合成氨的反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 2.24 L | B. | 1.12 L | C. | 0.672 L | D. | 0.448 L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com