
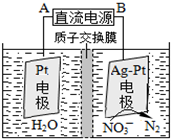
 氮氧化合物是大氣污染的重要因素.
氮氧化合物是大氣污染的重要因素.分析 (1)氮氣和氧氣在閃電的條件下轉化為一氧化氮;
(2)根據蓋斯定律來計算化學反應的焓變;
(3)根據氧化還原反應中氧化劑和還原劑的特點結合常見的氧化劑和還原劑來回答;
(4)①根據信息:用H2將NO3-還原為N2,一段時間后,溶液的堿性明顯增強,即生成氫氧根離子,據此書寫方程式;
②在電解池的陰極上發生得電子的還原反應,據此書寫電極反應.
解答 解:(1)氮氣和氧氣在閃電的條件下轉化為一氧化氮,反應為:N2+O2$\frac{\underline{\;放電或高溫\;}}{\;}$2NO,故答案為:N2+O2$\frac{\underline{\;放電或高溫\;}}{\;}$2NO;
(2)已知:①N2(g)+O2(g)═2NO(g)△H=+180.6kJ•mol-1
②C(s)+O2(g)═CO2(g)△H=-393.5kJ•mol-1
則反應 C(s)+2NO(g)═CO2(g)+N2(g)可以是②-①得到,所以該反應的△H=-393.5kJ•mol-1-180.6kJ•mol-1=-574.1kJ•mol-1,
C(s)+2NO(g)═CO2(g)+N2(g)△H=-574.1kJ•mol-1,
故答案為:-574.1;
(3)將NO2變成無害的N2中,氮元素的化合價降低了,二氧化氮做氧化劑,需要加入還原劑,在下列四種物質:a.NH3 b.CO2 c.SO2 d.CH3CH2OH中,能被二氧化氮氧化具有還原性的物質有乙醇和NH3,故答案為:還原劑;ad;
(4)①根據信息:用H2將NO3-還原為N2,一段時間后,溶液的堿性明顯增強,即生成氫氧根離子,發生的反應為:2NO3-+5H2$\frac{\underline{\;催化劑\;}}{\;}$N2+2OH-+4H2O,
故答案為:2NO3-+5H2$\frac{\underline{\;催化劑\;}}{\;}$N2+2OH-+4H2O;
②根據裝置圖示可以看出,右端電極上發生得電子的還原反應,即為陰極,反應式為:2NO3-+12 H++10e-=N2↑+6H2O,所以B是負極,A是正極,
故答案為:A;2NO3-+12 H++10e-=N2↑+6H2O.
點評 本題考查氧化還原反應,為高頻考點,把握反應中元素的化合價變化為解答的關鍵,側重分析與應用能力的考查,注意氧化還原反應與電化學的聯系,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 由題目信息知:KMnO4的氧化性比MnO2的強 | |
| B. | 制備氯氣的整個實驗過程中,只需要使用氧化劑與還原劑 | |
| C. | 用排氣法收集不需要利用其他試劑就能確定集氣瓶中已收集滿氣體 | |
| D. | 用足量MnO2與含有4 molHCl的濃鹽酸在加熱條件下反應,得到Cl2的物質的量小于1 mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
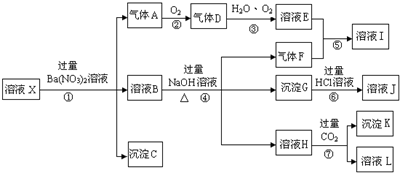
 ,沉淀K的化學式為:Al(OH)3,沉淀G的化學式為:Fe(OH)3,實驗中,可以觀察到反應②的現象是:氣體由無色變紅棕色.
,沉淀K的化學式為:Al(OH)3,沉淀G的化學式為:Fe(OH)3,實驗中,可以觀察到反應②的現象是:氣體由無色變紅棕色.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 (1)二氧化碳是一種重要的溫室氣體,減少二氧化碳的排放是解決溫室效應的有效途徑.目前,由二氧化碳合成二甲醚的研究工作已取得了重大進展,其化學反應方程式為2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚氣體的燃燒熱為1455kJ•mol-1,工業上用合成氣(CO、H2)直接或間接合成二甲醚.下列有關敘述正確的是AC.
(1)二氧化碳是一種重要的溫室氣體,減少二氧化碳的排放是解決溫室效應的有效途徑.目前,由二氧化碳合成二甲醚的研究工作已取得了重大進展,其化學反應方程式為2CO2(g)+6H2(g)?CH3OCH3(g)+3H2O(g)△H>0.二甲醚氣體的燃燒熱為1455kJ•mol-1,工業上用合成氣(CO、H2)直接或間接合成二甲醚.下列有關敘述正確的是AC.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 甲烷作為一種新能源在化學領域應用廣泛,請回答下列問題:
甲烷作為一種新能源在化學領域應用廣泛,請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com