
【題目】現有下列十種物質:①HCl;②NaHCO3;③K2SO4溶液;④SiO2;⑤蔗糖晶體;⑥NaOH;⑦氫氧化鐵膠體;⑧NH3·H2O;⑨空氣;⑩Al2(SO4)3
(1)上述物質中屬于電解質的有____(填序號),向⑦中逐滴滴入過量的①的水溶液,出現的實驗現象是___。
(2)用④與⑥焙燒制備硅酸鈉,可采用圖中的裝置為____(填選項編號)。
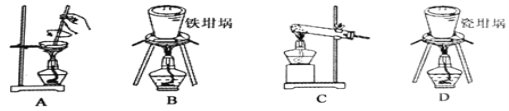
【答案】①②⑥⑧⑩ 先出現紅褐色沉淀后沉淀溶解,溶液呈黃色 B
【解析】
(1)電解質,在水溶液中或熔融狀態下能夠導電的化合物,包括了酸、堿、鹽、金屬氧化物、水;
①HCl,酸,溶于水能電離出H+和Cl-可以導電,是電解質;
②NaHCO3,鹽,在水溶液中能夠電離出Na+和HCO3-,能導電,是電解質;
③K2SO4溶液,是混合物,不是化合物,不是電解質;
④SiO2,不溶于水,在熔融狀態下,不電離,不是電解質;
⑤蔗糖,不管是在水溶液中,還是熔融狀態下,均不電離出離子,不導電,不是電解質;
⑥NaOH,堿,溶于水能電離出OH-和Na+,可以導電,是電解質;
⑦氫氧化鐵膠體,是混合物,不是化合物,不是電解質;
⑧NH3·H2O,在水溶液中,能夠電離出NH4+和OH-,是電解質;
⑨空氣,是混合物,不是化合物,不是電解質;
⑩Al2(SO4)3,在水溶液中,能夠電離出Al3+和SO42-,可以導電,是電解質;
是電解質的為①②⑥⑧⑩;
膠體遇到電解質溶液首先會發生聚成,然后Fe(OH)3與HCl反應生成FeCl3,現象為先出現紅褐色沉淀后沉淀溶解,溶液呈黃色;
(2)用SiO2與NaOH焙燒制備硅酸鈉,煅燒固體選擇坩堝,因此排除A和C,由于瓷坩堝的成分中含有二氧化硅,會與堿性物質反應,會被NaOH腐蝕,以免腐蝕瓷坩堝。因此不能選用瓷坩堝,而是鐵坩堝,答案選B。


 輕巧奪冠周測月考直通中考系列答案
輕巧奪冠周測月考直通中考系列答案科目:高中化學 來源: 題型:
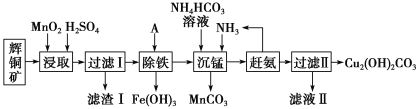
【題目】銅及其化合物在工業生產上有許多用途。某工廠以輝銅礦(主要成分為 Cu2S,含少量 Fe2O3、SiO2 等雜質)為原料制備不溶于水的堿式碳酸銅的流程如下:
已知:
①常溫下幾種物質開始形成沉淀與完全沉淀時的pH如下表
金屬離子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
開始沉淀 | 7.5 | 2.7 | 5.6 | 8.3 |
完全沉淀 | 9.0 | 3.7 | 6.7 | 9.8 |
② Ksp[Fe(OH)3]=4.0×10-38
(1)加快“浸取”速率,除適當增加硫酸濃度外,還可采取的措施有__________(任寫一種)。
(2)濾渣I中的主要成分是MnO2、S、SiO2,請寫出“浸取”反應中生成S的化學方程式:______________。
(3)常溫下“除鐵”時加入的試劑A可用CuO等,調節pH調的范圍為_________,若加 A 后溶液的 pH調為4.0,則溶液中 Fe3+的濃度為_________mol/L。
(4)寫出“沉錳”(除 Mn2+)過程中反應的離子方程式:_________________________。
(5)“趕氨”時,最適宜的操作方法是________________。
(6)過濾Ⅱ得到的沉淀經過洗滌、干燥可以得到堿式碳酸銅,判斷沉淀是否洗凈的操作是________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某實驗小組擬用小顆粒狀鋁硅合金與足量稀硫酸的反應(已知硅與稀硫酸不反應),測定通常狀況(20℃,101 kPa)下的氣體摩爾體積。擬選用下列實驗裝置完成實驗:

(1)該小組同學必須選用的裝置依次連接的合理順序為A、_____________。
(2)實驗開始時,先打開分液漏斗上口的玻璃塞,再輕輕打開其活塞,開始時稀硫酸能滴人錐形瓶中,一段時間后稀硫酸不能順利滴入錐形瓶中,其原因是____________________。
(3)金屬鋁與稀硫酸反應的離子方程式為_________________。
(4)實驗結束時,測量實驗中生成H2體積的操作方法是_______________。
(5)實驗中準確測得3個數據:實驗前鋁硅合金的質量m1g,實驗后殘留固體的質量m2g,實驗后量筒中液面讀數為V ml。。則通常狀況下氣體摩爾體積Vm=__________L·mol-l。若合金中含少量銅,則所測得的Vm將____________(填“偏大”“偏小”或“無影響”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】短周期元素中:A是地殼中含量最高的元素;B比Ne的質子數多1個;C最外層電子數與其電子層數相等;D單質是半導體材料;E非金屬性在同周期元素中最強。下列說法中正確的是
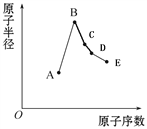
A. B離子的半徑比C離子的半徑小
B. C單質與A或E單質形成的化合物均為離子化合物
C. A、B兩單質反應可得到兩種不同的離子化合物
D. B最高價氧化物對應的水化物與0.1mol D單質充分反應放出4.48L氣體
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向100 mL NaOH溶液中通入一定量的CO2氣體,充分反應后,再向所得溶液中逐滴加入0.2 mol·L-1的鹽酸,產生CO2的體積與所加鹽酸體積之間關系如圖所示。下列判斷正確的是( )
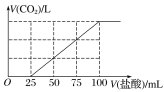
A. 原NaOH溶液的濃度為0.2 mol·L-1
B. 通入CO2在標準狀況下的體積為448 mL
C. 所得溶液的溶質成分的物質的量之比為n(NaOH)∶n(Na2CO3)=1∶3
D. 所得溶液的溶質成分的物質的量之比為n(NaHCO3)∶n(Na2CO3)=1∶1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】草酸亞鐵晶體(FeC2O4·2H2O,相對分子質量為180)呈淡黃色,可用作照相顯影劑。某實驗小組對其進行了一系列探究。
I.純凈草酸亞鐵晶體熱分解產物的探究。
(1)氣體產物成分的探究。小組成員采用如圖裝置(可重復選用)進行實驗:
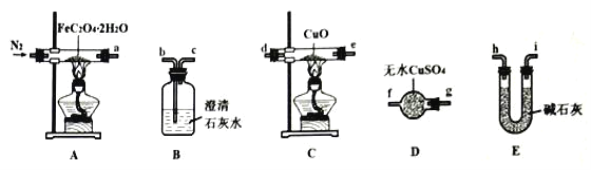
①裝置D的名稱為____。
②按照氣流從左到右的方向,上述裝置的連接順序為____→尾氣處理裝置(填圖中各儀器接口的字母編號)。
③實驗前先通入一段時間N2,其目的為____。
④實驗證明了氣體產物中含有CO,依據的實驗現象為_____。
(2)固體產物成分的探究。充分反應后,A處反應管中殘留黑色固體。小組成員設計實驗證明了其成分只有FeO,其實驗操作及現象為:___。
(3)依據(1)和(2)結論,可知A處反應管中發生反應的化學方程式為:___。
Ⅱ.草酸亞鐵晶體樣品純度的測定
工業制得的草酸亞鐵晶體中常含有FeSO4雜質,測定其純度的步驟如下(雜質不參與反應):
步驟1:稱取2g草酸亞鐵晶體樣品并溶于稀H2SO4中,配成250mL溶液。
步驟2:取上述溶液25.00mL,向其中加入0.01mol·L1KMnO4溶液,恰好完全反應時消耗 KMnO4溶液30mL。
[已知:FeC2O4+KMnO4+H2SO4→Fe2(SO4)3+CO2↑+MnSO4+K2SO4+H2O(未配平)]
(4)草酸亞鐵晶體樣品的純度為____;若步驟1配制溶液時部分Fe2+被氧化,則測定結果將____(填“偏高”、“偏低”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數的值,下列敘述中正確的是
A.在標準狀況下,1 mol SO3體積等于22.4 L
B.標準狀況下,7.1 g氯氣與足量氫氧化鈉稀溶液反應轉移的電子數為0.1NA
C.1 mol Fe(OH)3膠體中含有的膠粒數目為NA
D.2 L 0.5 mol·L1硫酸鉀溶液中陰離子所帶電荷數為NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】現有部分元素的性質與原子(或分子)結構如表所示:
元素編號 | 元素性質與原子(或分子)結構 |
T | 最外層電子數是次外層電子數的3倍 |
X | 常溫下單質分子為雙原子分子,分子中含有3對共用電子對 |
Y | M層比K層少1個電子 |
Z | 第三周期元素的金屬離子中半徑最小 |
(1)畫出元素T的原子結構示意圖:______。
(2)元素Y與元素Z相比,金屬性較強的是______(用元素符號表示),下列表述中能證明這一事實的是______(填字母)。
A.Y單質的熔點比Z單質低
B.Y的化合價比Z低
C.Y單質與水反應比Z單質與水反應劇烈
D.Y最高價氧化物對應的水化物的堿性比Z的強
(3)T、X、Y、Z中的兩種元素能形成既有離子鍵又有非極性共價鍵的化合物,寫出該化合物的化學式:______。
(4)T可以形成穩定的陰離子Tm-,Y可以形成穩定的陽離子Yn+,其半徑關系為r(Tm-)______r(Yn+)(填“>”,“<”或“=”)
(5)X、Y、Z的最高價氧化物對應的水化物可以相互發生反應,寫出Y、Z的最高價氧化物對應的水化物之間反應的離子方程式______________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“生活無處不化學”,回答下列問題:
(1)用白醋浸泡開水壺,第二天發現壺內水垢消失,開水壺又光潔如新了(水垢的主要成分是碳酸鈣等)。該離子反應方程式為____________。
(2)食鹽不慎灑落在天然氣的火焰上,觀察到的現象是_____,該變化稱為_____反應。
(3)沾有水的鐵制器皿在高溫火焰上會發黑,該反應的化學方程式是____________。
(4)面包在制作時會加入小蘇打,利用其加熱產生氣體的性質,可將小蘇打作為膨松劑,該反應的化學方程式是________________。
(5)光導纖維、沙子、石英和瑪瑙的主要成分是__________(填化學式)。
(6)賞心悅目的雕花玻璃是用__________(填名稱)對玻璃進行刻蝕而制成的。
(7)使用“84”消毒液(含NaClO)時,按一定比例將它與水混合,并在空氣中浸泡一段時間,使NaClO與H2O及空氣中的CO2充分反應,以達到殺菌消毒的效果更好的目的。將該反應的離子方程式補充完整:![]() ____+____。
____+____。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com