
【題目】已知五種元素的原子序數的大小順序為 C> A> B >D >E,A、C同周期,B、C同主族。A與B形成的離子化合物A2B中所有離子的電子數相同,其電子總數為30;D和E可形成4核10電子的分子。試回答下列問題:
(1)寫出以下元素的名稱 A_________ C_________
(2)B元素在元素周期表中的位置是_______________;D2分子的結構式是______________。
(3)實驗室制取D的氫化物的化學反應方程式為_________________________。
(4)用電子式表示化合物A2B的形成過程______________________。
(5)M、N均由A、B、C、E四種元素組成,寫出此兩種化合物在水溶液中發生反應的離子方程式____________________________。
【答案】 鈉 硫 第二周期第ⅥA族 ![]() 2NH4Cl+Ca(OH)2
2NH4Cl+Ca(OH)2![]() CaCl2+ 2H2O+2NH3↑
CaCl2+ 2H2O+2NH3↑ ![]() H++HSO3-=SO2+H2O
H++HSO3-=SO2+H2O
【解析】A與B形成離子化合物A2B,A2B中所有離子的電子數相同,且電子總數為30,所以每個離子都有10個電子,由化學式的結構可知,B帶2個單位負電荷,A帶1個單位正電荷,所以A是Na元素,B是O元素,因為A、C同周期,B與C同主族,所以C為S元素;D和E可形成4核10電子的分子,每個原子平均不到3個電子,可知其中一定含有氫原子,分子中有4個原子核共10個電子,一定是NH3,結合原子序數D>E,可知D是N元素,E是H元素,則
(1)由上述分析可知,A為鈉,C為硫;(2)氧元素位于第二周期第ⅥA族。氮氣的結構式為![]() 。(3)實驗室制備氨氣的方程式為2NH4Cl+Ca(OH)2
。(3)實驗室制備氨氣的方程式為2NH4Cl+Ca(OH)2![]() CaCl2+ 2H2O+2NH3↑。(4)A2B是Na2O,由鈉離子與氧離子形成的離子化合物,Na2O的形成過程為
CaCl2+ 2H2O+2NH3↑。(4)A2B是Na2O,由鈉離子與氧離子形成的離子化合物,Na2O的形成過程為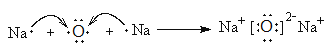 ;(3)M、N均由A、B、C、E四種元素組成,分別是硫酸氫鈉和亞硫酸氫鈉,兩種化合物在水溶液中發生反應的離子方程式為 H++HSO3-=SO2↑+H2O。
;(3)M、N均由A、B、C、E四種元素組成,分別是硫酸氫鈉和亞硫酸氫鈉,兩種化合物在水溶液中發生反應的離子方程式為 H++HSO3-=SO2↑+H2O。


科目:高中化學 來源: 題型:
【題目】已知水的電離平衡曲線如圖示,試回答下列問題:

(1)圖中五點Kw間的關系是 。
(2)若從A點到D點,可采用的措施是 。
A.升溫 B.加入少量的鹽酸 C.加入少量的NH4Cl
(3)E對應的溫度下,將pH=9的NaOH溶液與pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,則NaOH溶液與H2SO4溶液的體積比為 。
(4)B對應溫度下,將pH=11的苛性鈉溶液V1 L與0.05mol/L的稀硫酸V2L 混合(設混合后溶液的體積等于原兩溶液體積之和),所得混合溶液的pH=2,則 V1∶V2=________________。
(5)常溫下,將V mL、0.1000mol·L-1氫氧化鈉溶液逐滴加入到20.00mL、0.1000mol·L-1醋酸溶液中充分反應。請回答下列問題(忽略溶液體積的變化)
①如果溶液pH=7,此時V的取值___________20.00(填“>”“<”或“=”)。而溶液 中c(Na+)、c(CH3COO-)、c(H+)、c(OH-)的大小關系為___________。
②如果V=40.00,則此時溶液中c(OH-)-c(H+)-c(CH3COOH)=______ ___mol·L-1(填數據)
(6)在0.10 mol·L-1硫酸銅溶液中加入氫氧化鈉稀溶液充分攪拌,有淺藍色氫氧化銅沉淀生成,當溶液的pH=8時,c(Cu2+)= mol·L-1。(Ksp[Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列指定反應的離子方程式正確的是
A. 用醋酸除去水垢中的碳酸鈣:CaCO3+2H+=Ca2++H2O+CO2↑
B. 硫化鈉水溶液呈堿性的原因:S2-+2H2O![]() H2S↑+2OH-
H2S↑+2OH-
C. 向NaHCO3溶液中加入少量的Ba(OH)2溶液:Ba2++OH- +HCO3- =BaCO3↓+ 2H2O
D. 向Na2FeO4溶液中加入稀硫酸產生氧氣:4FeO42-+20H+=4Fe3++3O2↑+10H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以NaCl等為原料制備KClO4的過程如下:
①在無隔膜、微酸性條件下,發生反應:NaCl+H2O—NaClO3+H2↑(未配平)
②在NaClO3溶液中加入KCl發生復分解反應,降溫結晶,得KClO3。
③一定條件下反應:4KClO3=3KClO4+KCl,將產物分離得到KClO4。
(1)電解時,產生質量為2.13g NaClO3,同時得到H2的體積為____________L(標準狀況)。
(2)向NaClO3溶液中加入KCl能得到KClO3的原因是________________。

(3)該過程制得的KClO4樣品中含少量KCl雜質,為測定產品純度進行如下實驗:
準確稱取5.689g樣品溶于水中,配成250mL溶液,從中取出25.00mL于錐形瓶中,加入適量葡萄糖,加熱使ClO4-全部轉化為Cl- (反應為:3 KClO4+C6H12O6 ═ 6 H2O + 6 CO2↑+ 3 KCl),加入少量K2CrO4溶液作指示劑,用0. 20mol/L AgNO3溶液進行滴定至終點,消耗AgNO3溶液體積21.00mL。滴定達到終點時,產生磚紅色Ag2CrO4沉淀。
① 已知:Ksp(AgCl)=1.8×10-10,Ksp(Ag2CrO4)=1.1×10-12,若c(CrO42-)=1.1×10-4mol/L,則此時c(Cl-)=________________mol/L。
② 計算KClO4樣品的純度(請寫出計算過程。)______________________________
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com