
【題目】氫化鈣固體是登山運動員常用的能源提供劑.某興趣小組擬選用如下裝置制備氫化鈣. 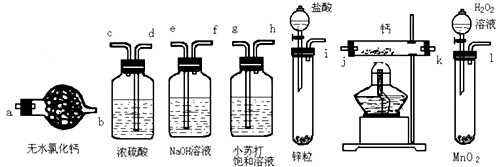
請回答下列問題:
(1)請選擇必要的裝置,按氣流方向連接順序為(填儀器接口的字母編號);
(2)根據完整的實驗裝置進行實驗,實驗步驟如下:檢查裝置氣密性后,裝入藥品;打開分液漏斗活塞;(請按正確的順序填入下列步驟的標號);
A.加熱反應一段時間
B.收集氣體并檢驗其純度
C.關閉分液漏斗活塞
D.停止加熱,充分冷卻
(3)實驗結束后,某同學取少量產物,小心加入水中,觀察到有氣泡冒出,溶液中加入酚酞后顯紅色,該同學據此推斷,上述實驗確有CaH2生成. ①寫出CaH2與水反應的化學方程式;
②該同學的判斷不正確,原因是(用相關化學方程式表示) .
【答案】
(1)iefabjk(或k,j)d
(2)ABCD
(3)CaH2+2H2O=Ca(OH)2+2H2↑;Ca+2H2O═Ca(OH)2+H2↑
【解析】解:(1)鈣屬于極活潑的金屬,極易與水反應生成氫氧化鈣和氫氣,而制備的氫氣中會混有水蒸氣和氯化氫,所以在與鈣化合之前需要除雜和干燥,分別選用試劑是氫氧化鈉和濃硫酸;同時為防止空氣中水蒸氣進入,最后還需要連接干燥管,所以正確的順序為:ief ab j k(或k,j)d;所以答案是:ief ab j k(或k,j)d;(2)由于多余的氫氣需要燃燒反應掉,所以應該先收集一部分氣體并檢驗其純度,反應結束后還需要使氫化鈣在氫氣的氛圍中冷卻,所以應該最后關閉分液漏斗活塞,因此正確的順序為BADC,所以答案是:BADC;(3)CaH2和Ca與水反應都能產生Ca(OH)2和H2 , 反應方程式分別為:CaH2+2H2O=Ca(OH)2+2H2↑和Ca+2H2O=Ca(OH)2+H2↑,因此不能根據反應后溶液呈堿性判斷是否含有CaH2 , 所以答案是:CaH2+2H2O=Ca(OH)2+2H2↑;Ca+2H2O═Ca(OH)2+H2↑.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】下列各組離子能在溶液中大量共存的是( )
A. Ag+、K+、NO3﹣、Cl﹣ B. Mg2+、Na+、Cl﹣、SO42﹣
C. Ca2+、Mg2+、OH﹣、Cl﹣ D. H+、Na+、CO32﹣、SO42﹣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A,B,C,D,E,F為原子序數依次增大的短周期主族元素.A、F原子的最外層電子數均等于其周期序數,F原子的電子層數是A的3倍;B原子核外電子分處3個不同能級且每個能級上的電子數相同;A與C形成的分子為三角錐形;D原子p軌道上成對的電子總數等于未成對的電子總數;E原子核外每個原子軌道上的電子都已成對,E電負性小于F.
(1)A,C形成的分子極易溶于水,與該分子互為等電子體的陽離子為 .
(2)比較E、F的第一電離能:E(填“>”或“<”)F.
(3)BD2在高溫高壓下所形成的晶胞如圖所示.該晶體的類型屬于(填“分子”“原子”“離子”或“金屬”)晶體,該晶體中B原子的雜化形式為 . 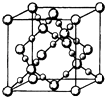
(4)單質F與強堿溶液反應有[F(OH)4]﹣生成,則[F(OH)4]﹣中存在(填字母). a.共價鍵 b.非極性鍵 c.配位鍵 d.σ鍵 e.π鍵
(5)Cu晶體是面心立方體,立方體的每個面5個Cu原子緊密堆砌,已知每個Cu原子的質量為a g,Cu原子半徑為d cm,求該晶體的密度為gcm﹣3 . (用含a、d的代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NH3和HNO3是重要的工業產品,下圖為合成氨以及氨氧化制硝酸的流程。
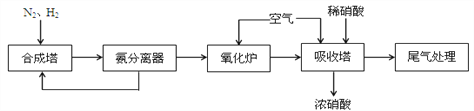
(1)合成塔中發生反應的化學方程式是_______________________________
從氨分離器中又回到合成塔中的物質是_________________。
(2)氧化爐中發生反應的化學方程式是_________________________________________
(3)尾氣中的少量NO、NO2可以用NH3來處理,在催化劑作用下生成無污染的氣體,寫出NO2和 NH3反應的化學方程式__________________________________________________
當有5.6L NO2被還原時,轉移電子的物質的量為 ________________mol.
(4)氧化爐中出來的氣體,先降溫再進入吸收塔,吸收塔中通入空氣的作用是_________________.若進入吸收塔的氣體的體積分數為NO210.0%,NO 1.32%,其余為N2、水蒸氣等.當進入吸收塔中氣體為10m3時,最少需要空氣的體積為_____________m3。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,1mol化學鍵分解成氣態原子所需要的能量用E表示,結合表中信息判斷下列說法不正確的是( )
共價鍵 | H-H | F-F | H-F | H-Cl | H-I |
E(kJ·mol1) | 436 | 157 | 568 | 432 | 298 |
A. 表中最穩定的共價鍵是H-F
B. 1mol H2(g)與1mol F2(g)生成2molHF(g)放出25kJ的能量
C. 432kJ·mol1>E(H-Br)>298kJ·mol1
D. 1mol H2(g)分解成2mol H(g) 需吸收436kJ的能量
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硫酸的年產量可以用來衡量一個國家的化工生產能力.工業生產硫酸的流程中存在反應:2SO2(g)+O2(g)2SO3(g).反應體系中SO3的百分含量和溫度的關系如圖所示(曲線上任何一點都表示平衡狀態).根據圖示回答下列問題:
(1)畫出硫原子的結構示意圖
(2)下列說法正確的是a.若在恒溫、恒壓條件下向上述平衡體系中通入氦氣,平衡不移動
b.在D點時,v正>v逆
c.B點、C點反應的平衡常數分別為K1、K2 , 則K1<K2
d.在A點時,消耗1mol SO2必定同時消耗1mol SO3 .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列四種鹽酸溶液,均能跟鋅片反應,其中最初反應速率最快的是( )
A.10℃ 20mL 3mol/L的鹽酸溶液B.20℃ 10mL 4mol/L的鹽酸溶液
C.20℃ 20mL 2mol/L的鹽酸溶液D.20℃ 30mL 2mol/L的鹽酸溶液
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com