
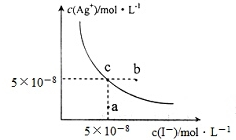
| A. | 在t℃時,Agl的Ksp=2.5×10-15 | |
| B. | 圖中b點有碘化銀晶體析出 | |
| C. | 向c點溶液中加入適量蒸餾水,可使溶液由c點到a點 | |
| D. | 在t℃時,反應AgBr(s)+I-(aq)?Agl(s)+Br-(aq)的平衡常數K=200 |
分析 A.根據c點銀離子、碘離子的濃度計算t℃時AgI的Ksp;
B.b點時碘離子濃度大于5×10-8mol/L,此時為碘化銀的過飽和溶液;
C.向c點溶液中加入適量蒸餾水,碘離子濃度一定減小,則c(I-)<5×10-8mol/L;
D.t℃時,反應AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常數K=$\frac{c(B{r}^{-})}{c({I}^{-})}$=$\frac{{K}_{sp}(AgBr)}{{K}_{sp}(AgI)}$.
解答 解:A.t℃時,根據圖象中c點銀離子、溴離子濃度分別為:c(I-)=5×10-8mol/L,c(Ag+)=5×10-8mol/L,則Ksp(AgI)=c(I-)×c(Ag+)=5×10-8mol/L×5×10-8mol/L=2.5×10-15 mol2•L-2,故A正確;
B.b點c(Ag+)=5×10-8mol/L,c(I-)>5×10-8mol/L,則c(I-)×c(Ag+)>Ksp(AgI),所以會析出AgI沉淀,故B正確;
C.向c點溶液中加入適量蒸餾水,溶液體積增大,導致c(I-)<5×10-8mol/L,不可能使溶液由c點到a點,故C錯誤;
D.t℃時,Ksp(AgI)=c(I-)×c(Ag+)=2.5×10-15,Ksp(AgBr)=5×10-13,反應AgBr(s)+I-(aq)?AgI(s)+Br-(aq) 的平衡常數K=$\frac{c(B{r}^{-})}{c({I}^{-})}$=$\frac{{K}_{sp}(AgBr)}{{K}_{sp}(AgI)}$=$\frac{5×1{0}^{-13}}{2.5×1{0}^{-15}}$=200,故D正確;
故選C.
點評 本題考查了難溶物溶解平衡及其影響,為高頻考點,題目難度中等,明確難溶物溶度積的概念及表達式為解答關鍵,注意掌握難溶物溶解平衡及其影響,試題培養了學生的分析能力及靈活應用能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 反應 | 大氣固氮 N2(g)+O2(g)?2NO(g) | 工業固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 溫度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
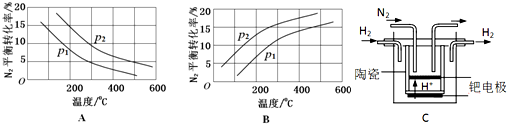
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 時間/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
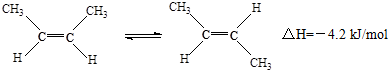
| A. | 順-2-丁烯比反-2-丁烯穩定 | |
| B. | 順-2-丁烯的燃燒熱比反-2-丁烯大 | |
| C. | 加壓和降溫有利于平衡向生成順-2-丁烯反應方向移動 | |
| D. | 它們與氫氣加成反應后的產物具有不同的沸點 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | B的消耗速率與B的生成速率相等 | |
| B. | 單位時間內消耗3a mol C,同時生成a mol A | |
| C. | 容器內的壓強不再變化 | |
| D. | 混合氣體的密度不再變化 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com