
| 時間/min | 0 | 10 | 20 | 30 |
| n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 |
分析 (1)由CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol…Ⅰ,CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol…Ⅱ,目標反應CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g),得Ⅱ-Ⅰ得:CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g),根據蓋斯定律分析求解;
(2)①平衡時的量比20min的量小,但變化量小于10min-20min,所以0.22<n<0.26;
②根據三行式求變化量;
(3)葡萄糖到葡萄糖酸[CH2OH(CHOH)4COOH]發生氧化反應,所以在陽極產生,電極反應式為:CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
解答 解:(1)由CH4+$\frac{1}{2}$O2(g)?CH3OH(g)△H=-128.5kJ/mol…Ⅰ,CH4(g)+O2(g)→HCHO(g)+H2O(g)△H=c kJ/mol…Ⅱ,目標反應CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g),得Ⅱ-Ⅰ得:CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1,
故答案為:CH3OH(g)+$\frac{1}{2}$O2(g)→HCHO(g)+H2O(g)△H=(c+128.5)KJ•L-1;
(2)①平衡時的量比20min的量小,但變化量小于10min-20min,所以0.22<n<0.26,故答案為:0.22<n<0.26;
②C8H10(g)?C8H8(g)+H2(g)
開始 0.40mol 0 0
變化 x x x
平衡 0.40mol-x x x
所以:$\frac{0.4+x}{0.4}$=1.4,解之得:x=0.16,所以苯乙烷的轉化率為$\frac{0.16}{0.4}$=40%,故答案為:40%;
(3)葡萄糖到葡萄糖酸[CH2OH(CHOH)4COOH]發生氧化反應,所以在陽極產生,電極反應式為:CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+;
故答案為:陽;CH2OH(CHOH)4CHO+H2O-2e-═CH2OH(CHOH)4COOH+2H+.
點評 本題考查外界條件對化學平衡的影響、蓋斯定律、三行式的應用和電極反應式的書寫,綜合性強,有一定的難度.


 舉一反三同步巧講精練系列答案
舉一反三同步巧講精練系列答案 口算與應用題卡系列答案
口算與應用題卡系列答案 名師點睛字詞句段篇系列答案
名師點睛字詞句段篇系列答案科目:高中化學 來源: 題型:填空題
 的系統名稱是3-甲基-1-丁烯,將其在催化劑存在下完全氫化,所得烷烴的系統名稱是2-甲基丁烷.該烷烴的一氯代物最多有4種.
的系統名稱是3-甲基-1-丁烯,將其在催化劑存在下完全氫化,所得烷烴的系統名稱是2-甲基丁烷.該烷烴的一氯代物最多有4種. .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
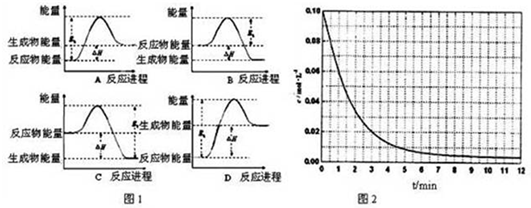
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
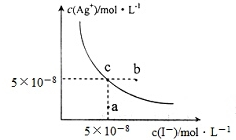
| A. | 在t℃時,Agl的Ksp=2.5×10-15 | |
| B. | 圖中b點有碘化銀晶體析出 | |
| C. | 向c點溶液中加入適量蒸餾水,可使溶液由c點到a點 | |
| D. | 在t℃時,反應AgBr(s)+I-(aq)?Agl(s)+Br-(aq)的平衡常數K=200 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 熱化學方程式中,化學式前面的化學計量數既可表示微粒數,又可表示物質的量 | |
| B. | 熱化學方程式中,如果沒有注明溫度和壓強則表示在標準狀況下測得的數據 | |
| C. | 書寫熱化學方程式時,不僅要寫明反應熱的符號和數值,還要注明各物質的聚集狀態 | |
| D. | 1mol碳燃燒所放出的熱量為燃燒熱,1mol強酸和1mol強堿完全反應所放出的熱稱為中和熱 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
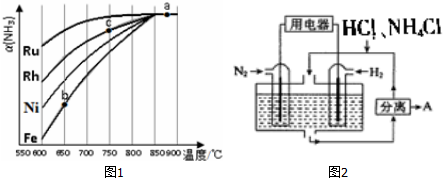
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
| 實驗序號 | 實驗方法 | 實驗現象 | 結論 |
| ① | 將氯水滴加到AgNO3溶液中 | 生成白色沉淀 | |
| ② | 將氯水滴加到紫色石蕊試液中 | 氯水中不僅有H+還有HClO | |
| ③ | 將氯水滴加到淀粉-KI試紙上 | 淀粉-KI試紙變藍 (I2遇淀粉變藍) | 氯水中有Cl2 |
| ④ | 將足量的氯水滴加到NaHCO3溶液中 | 有氣泡生成 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com