
 .
.| 電負性 | 熔沸點 | 穩定性 | 酸性 |
| O>N | NH3>PH3 | Fe2+< Fe3+ | H3PO4<HNO3 |
分析 (1)根據P結構示意圖為 結合主族元素周期數=電子層數、主族族序數=最外層電子數判斷;Cr原子為24號元素,其滿足半滿和全滿的穩定結構,據此書寫其基態原子價層電子排布式;O的一種18電子結構氫化物為雙氧水,雙氧水為共價化合物,氧原子最外層8個電子,分子中存在兩個氧氫鍵,1個氧氧單鍵;
結合主族元素周期數=電子層數、主族族序數=最外層電子數判斷;Cr原子為24號元素,其滿足半滿和全滿的穩定結構,據此書寫其基態原子價層電子排布式;O的一種18電子結構氫化物為雙氧水,雙氧水為共價化合物,氧原子最外層8個電子,分子中存在兩個氧氫鍵,1個氧氧單鍵;
(2)同周期從左到右元素的非金屬性增強,電負性增強;物質的熔沸點與晶體類型有關,分子晶體中存在氫鍵的熔點大于沒有氫鍵的;二價鐵易被氧化成三價鐵,所以三價鐵比較穩定;元素的非金屬性越強,其最高價氧化物的水化物的酸性越強;
(3)利用電解生成的Fe2+而將酸性含鉻廢水(K2Cr2O7)中的鉻元素還原為三價,本身氧化成Fe3+,結合氧化還原反應電子得失守恒配平;
(4)①3Fe (s)+2O2(g)═Fe3O4(s)△H=-1118.4kJ•mol-1,
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol,
依據蓋斯定律①-②×2書寫熱化學方程式,標注物質聚集狀態和對應焓變.
解答 解:(1)磷為15號元素,其原子結構示意圖為 ,又元素周期數=電子層數、主族族序數=最外層電子數,所以原子核外有3個電子層,處于第三周期,最外層電子數為5,處于ⅤA族;Cr原子為24號元素,其滿足半滿和全滿的穩定結構,基態原子價層電子排布式為3d54s1;O的一種18電子結構氫化物為雙氧水,雙氧水為共價化合物,氧原子最外層8個電子,分子中存在兩個氧氫鍵,1個氧氧單鍵,雙氧水的電子式為
,又元素周期數=電子層數、主族族序數=最外層電子數,所以原子核外有3個電子層,處于第三周期,最外層電子數為5,處于ⅤA族;Cr原子為24號元素,其滿足半滿和全滿的穩定結構,基態原子價層電子排布式為3d54s1;O的一種18電子結構氫化物為雙氧水,雙氧水為共價化合物,氧原子最外層8個電子,分子中存在兩個氧氫鍵,1個氧氧單鍵,雙氧水的電子式為 ,故答案為:三;ⅤA;3d54s1;
,故答案為:三;ⅤA;3d54s1; ;
;
(2)同周期從左到右元素的非金屬性增強,電負性增強,所以電負性O>N;
物質的熔沸點與晶體類型有關,分子晶體中存在氫鍵的熔點大于沒有氫鍵的,又氨氣分子間存在氫鍵,所以熔沸點NH3>PH3;
因為二價鐵易被氧化成三價鐵,所以穩定性:Fe2+<Fe3+;
元素的非金屬性越強,其最高價氧化物的水化物的酸性越強,非金屬性:P<N,所以酸性:H3PO4<HNO3;
故答案為:>;>;<;<;
(3)利用電解生成的Fe2+而將酸性含鉻廢水(K2Cr2O7)中的鉻元素還原為三價,本身氧化成Fe3+,則離子方程式為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,
故答案為:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)①3Fe (s)+2O2(g)═Fe3O4(s)△H=-1118.4kJ•mol-1,
②2H2(g)+O2(g)=2H2O(g)△H=-483.6KJ/mol,
依據蓋斯定律①-②×2得到:3Fe(s)+4H2O(g)═Fe3O4(s)+4H2(g)△H=-151.2KJ/mol;
故答案為:-151.2KJ/mol.
點評 本題考查了原子結構的推斷及其性質的比較,鉻及其化合物的性質、氧化還原反應,熱化學方程式書寫和蓋斯定律計算應用,題目難度中等.


科目:高中化學 來源: 題型:解答題
 ,D的核磁共振氫譜圖中將出現4種峰;
,D的核磁共振氫譜圖中將出現4種峰; ;
;
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
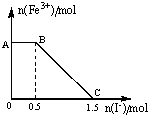 將一定量經硫酸酸化的KMnO4溶液與FeSO4溶液混合,充分反應后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物質的量隨加入的KI的物質的量的變化關系如圖所示,下列有關說法不正確的是( )
將一定量經硫酸酸化的KMnO4溶液與FeSO4溶液混合,充分反應后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物質的量隨加入的KI的物質的量的變化關系如圖所示,下列有關說法不正確的是( )| A. | 圖中AB段發生的是過量的酸性KMnO4溶液與KI的反應 | |
| B. | 從題中可以得出還原性:I->Fe2+>Mn2+ | |
| C. | 取B點以后的少量溶液滴入幾滴KSCN溶液,溶液變紅色 | |
| D. | 根據OC段的數據可知,開始加入的KMnO4的物質的量為0.5mol |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 $\stackrel{催化劑}{→}$
$\stackrel{催化劑}{→}$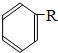 +HCl(R、R1、R2均為烴基)
+HCl(R、R1、R2均為烴基)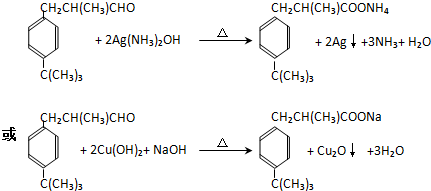 .
. .
.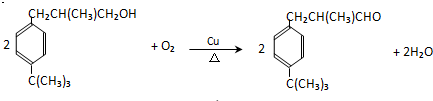 .
.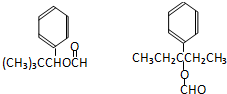 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
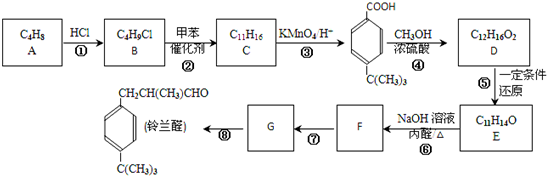
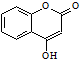 是一種醫藥中間體.常用來制備抗凝血藥,可通過下列路線合成:
是一種醫藥中間體.常用來制備抗凝血藥,可通過下列路線合成:

 和乙醇為原料,制備
和乙醇為原料,制備  的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.
的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:CH2=CH2$\stackrel{HBr}{→}$ CH3CH2Br$→_{△}^{NaOH}$CH3CH2OH.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
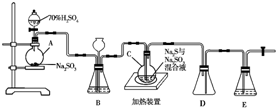 工業上常利用含硫廢水生產Na2S2O3•5H2O,實驗室可用如下裝置(略去部分夾持儀器)模擬生產過程.燒瓶C中發生反應如下:
工業上常利用含硫廢水生產Na2S2O3•5H2O,實驗室可用如下裝置(略去部分夾持儀器)模擬生產過程.燒瓶C中發生反應如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 $\stackrel{△}{→}$
$\stackrel{△}{→}$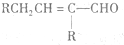 兔耳草醛是重要的合成香料,它具有獨特的新鮮水果的清香.由枯茗酸
兔耳草醛是重要的合成香料,它具有獨特的新鮮水果的清香.由枯茗酸 合成兔耳草醛的路線如下:
合成兔耳草醛的路線如下:
 、
、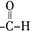 (寫結構式);檢驗B中含氧官能團的實驗方案是配制銀氨溶液,取少量B加入新配制的銀氨溶液中,然后水浴加熱
(寫結構式);檢驗B中含氧官能團的實驗方案是配制銀氨溶液,取少量B加入新配制的銀氨溶液中,然后水浴加熱 .
. 、
、 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 L 1 mol•L-1的醋酸溶液中含有的醋酸分子數為NA | |
| B. | 電解精煉銅時,當陽極上質量減少6.4 g時,電路中轉移的電子數為2NA | |
| C. | 常溫下,46 g NO2和N2O4的混合物中含有的氧原子數為2NA | |
| D. | 11.2 L CO2中含有的分子數為0.5NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com