
在反應3Cl2 + 8NH3 → 6NH4Cl + N2中,設阿伏加德羅常數為NA。則下列說法正確的是
A.若有0.3 mol Cl2參加反應,轉移的電子數為0.6NA
B.若生成2.24 L氮氣,轉移的電子數為0.6NA
C.若有1.2NA個電子發(fā)生轉移,則被氧化的氨氣的質量是27.2 g
D.若生成1 mol的氯化銨轉移電子數是n個,則NA=1/n
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源:2015屆河北省“五個一名校聯盟”高三教學質量監(jiān)測(一)化學試卷(解析版) 題型:選擇題
下列說法不正確的是
A.膠體的分散質粒子直徑大小介于溶液與濁液之間
B.金屬冶煉通常利用氧化還原反應原理
C.陶瓷、水泥和光導纖維均屬于硅酸鹽材料
D.“煤改氣”、“煤改電”等清潔燃料改造工程有利于減少霧霾天氣
查看答案和解析>>
科目:高中化學 來源:2015屆河北正定中學上學期高三第一次考試化學試卷(解析版) 題型:選擇題
SCR法(選擇性催化還原技術)是一種以NH3作為還原劑,將煙氣中NOx分解
成無害的N2和H2O的干法脫硝技術,反應原理為:①6NO+4NH3=5N2+6H2O;
②6NO2+8NH3=7N2+12H2O;③NO+NO2+2NH3=2N2+3H2O下列說法正確的是( )
A.NOx主要來自于汽車尾氣的排放,是引起溫室效應的主要氣體之一
B.N2中π鍵與σ鍵之比為1:2
C.反應③中每生成22.4LN2,轉移電子數1.5NA
D.NH3的沸點比PH3的沸點高
查看答案和解析>>
科目:高中化學 來源:2015屆河北正定中學上學期高三第一次考試化學試卷(解析版) 題型:選擇題
下列化學反應的離子方程式正確的是( )
A.氫氧化鎂中滴加鹽酸:H++OH-=H2O
B.用FeCl3溶液腐蝕銅電路板:Fe3++Cu=Fe2++Cu2+
C.在硫酸氫鉀溶液中加入氫氧化鋇溶液至pH=7:H++SO42-+Ba2++OH-=BaSO4↓+H2O
D.NH4HCO3溶液中加入過量NaOH溶液并加熱:NH4++HCO3-+2OH- NH3?+CO32-+2H2O
NH3?+CO32-+2H2O
查看答案和解析>>
科目:高中化學 來源:2015屆江西省高三暑期化學試卷(解析版) 題型:選擇題
(9分)氧化還原反應在生產、生活中具有廣泛的用途,貫穿古今。
(1)水是人體的重要組成成分,是人體中含量最多的一種物質。而“四種基本反應類型與氧化還原反應的關系”也可用如下圖表達。
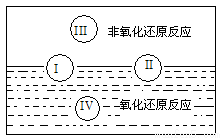
試寫出有水參加的符合反應類型Ⅳ的一個化學方程式:___________________,其中水為________劑
(2)氯化銨常用作焊接。如:在焊接銅器時用氯化銨除去銅器表面的氧化銅以便焊接,其反應為:
CuO+____NH4Cl ____Cu+____CuCl2+N2↑+____H2O。
____Cu+____CuCl2+N2↑+____H2O。
①配平此氧化還原反應方程式。
②該反應中,被氧化的元素是________(填元素名稱),氧化劑是________(填化學式)。
(3)磷酸鈣與焦炭、石英砂混合,在電爐中加熱到1 500 ℃生成白磷,反應為:
2Ca3(PO4)2+6SiO2===6CaSiO3+P4O10, 10C+P4O10===P4+10CO。
每生成1 mol P4時,就有________mol電子發(fā)生轉移。
查看答案和解析>>
科目:高中化學 來源:2015屆江西省高三暑期化學試卷(解析版) 題型:選擇題
在過量的稀硫酸溶液中加入5.6g鐵粉,待反應完全后,再加入50 mL 0.5mol·L-1 KNO3溶液,恰好反應完全。該反應的方程式為:__FeSO4+__KNO3+__H2SO4===__K2SO4+__Fe2(SO4)3+__NxOy +__H2O,則對該反應的下列說法正確的是( )。
A.反應中還原產物是NO
B.化學方程式中按物質順序的計量數是:8、2、5、1、4、1、5
C.反應過程中轉移的電子數為8e-
D.氧化產物和還原產物的物質的量之比為1∶4
查看答案和解析>>
科目:高中化學 來源:2015屆江西省高三上學期第一次月考化學試卷(解析版) 題型:選擇題
將8gFe2O3投入150mL某濃度的稀硫酸中,再投入7g鐵粉收集到1.68LH2(標準狀況),同時,Fe和Fe2O3均無剩余,為了中和過量的硫酸,且使溶液中鐵元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。則原硫酸的物質的量濃度為 ( )
A.1.5 mol·L-1 B.0.5 mol·L-1 C.2 mol·L-1 D. 1.2 mol·L-1
查看答案和解析>>
科目:高中化學 來源:2015屆江西省高三上學期第一次月考化學試卷(解析版) 題型:填空題
氨在國民經濟中占有重要地位。
(1)NH3的電子式為
(2)實驗室中制取氨氣的化學方程式為 ,
(3)欲快速制取氨氣,可將濃氨水滴入固體氫氧化鈉中,其裝置如下圖,請結合化學用語 從化學平衡的角度解釋:
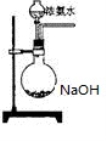
(4)將SO2氣體通入氯化鋇溶液,未見有沉淀生成,繼續(xù)通入NH3,則出現白色沉淀,請寫出反應的離子方程式 ;若將SO2氣體通入酸化的硝酸鋇溶液,也產生白色沉淀,用離子方程式加以說明
(5)氨和肼(N2H4)是氮的兩種常見化合物,在科學技術和生產中有重要的應用。
肼——空氣燃料電池是一種堿性電池,該電池放電時,負極的反應式 。
(6)氮氧化物的排放會對空氣造成污染,利用氧化法除去煙氣中的氮氧化物。
首先向氮氧化物中補充氧氣,然后將混合氣體通入石灰乳中,使之轉化為硝酸鈣。
已知某氮氧化物由NO和NO2組成,且n(NO):n(NO2)=1:3.
寫出氧化吸收法除去氮氧化物的化學方程式______________ _____
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com