
| A. | M的相對原子質量為32 | B. | M的相對原子質量為64 | ||
| C. | 電解過程中溶液的pH不發生變化 | D. | 電路中通過0.05mol電子 |
分析 用鉑電極電解某金屬的氯化物(MCl2)溶液,當陽極上收集到1.12LCl2時(標準狀況),n(Cl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,陰極增重3.2g,
A.生成0.05mol氯氣轉移0.1mol電子,根據轉移電子相等計算M的相對原子質量;
B.生成0.05mol氯氣轉移0.1mol電子,根據轉移電子相等計算M的相對原子質量;
C.根據題干知,電解過程中放電物質是電解質,該氯化物是強酸弱堿鹽,水溶液呈酸性;
D.根據氯氣和轉移電子之間的關系式計算.
解答 解:用鉑電極電解某金屬的氯化物(MCl2)溶液,當陽極上收集到1.12LCl2時(標準狀況),n(Cl2)=$\frac{1.12L}{22.4L/mol}$=0.05mol,陰極增重3.2g,
A.生成0.05mol氯氣轉移物質的量=0.05mol×2=0.1mol,根據轉移電子相等知,生成M的物質的量=$\frac{0.1mol}{2}$=0.05mol,根據轉移電子相等得M摩爾質量=$\frac{3.2g}{0.05mol}$=64g/mol,摩爾質量在數值上等于其相對原子質量,所以M的相對原子質量是64,故A錯誤;
B.根據A知,M的相對原子質量是64,故B正確;
C.根據題干知,電解過程中放電物質是電解質,該氯化物是強酸弱堿鹽,水溶液呈酸性,所以隨著電解的進行,溶液的pH增大,故C錯誤;
D.根據氯氣和轉移電子之間的關系式得轉移電子物質的量=0.05mol×2=0.1mol,故D錯誤;
故選B.
點評 本題考查電解原理,側重考查分析計算能力,明確溶質的性質利用轉移電子守恒解答即可,易錯選項是C,題目難度不大.


 優翼小幫手同步口算系列答案
優翼小幫手同步口算系列答案科目:高中化學 來源: 題型:解答題
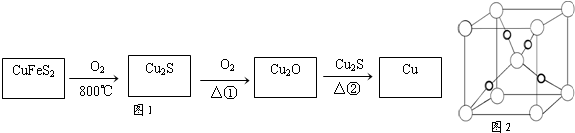
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 單位時間內生成n mol B,同時消耗3n mol C | |
| B. | 容器內壓強不隨時間而變化 | |
| C. | 混合氣體的密度不隨時間變化 | |
| D. | 單位時間內生成2n mol A,同時生成n mol D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3COONa | B. | NH3•H2O | C. | HCl | D. | H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu(OH) 2 | B. | Cu | C. | CuSO4 | D. | CuO |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
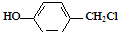 與NaOH水溶液共熱,生成的有機物的結構簡式為
與NaOH水溶液共熱,生成的有機物的結構簡式為 ;
; ;若該有機物有一個反式異構體,且能與氫氣加成生成2-甲基戊烷,則該有機物的結構簡式為
;若該有機物有一個反式異構體,且能與氫氣加成生成2-甲基戊烷,則該有機物的結構簡式為 ;
;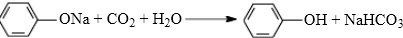 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com