
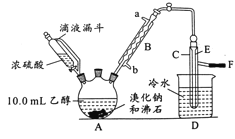
【題目】實驗室用乙醇、濃硫酸和溴化鈉反應來制備溴乙烷,其反應原理為H2SO4(濃)+NaBr![]() NaHSO4+HBr↑、CH3CH2OH+HBr
NaHSO4+HBr↑、CH3CH2OH+HBr![]() CH3CH2Br+H2O。有關數據和實驗裝置如(反應需要加熱,圖中省去了加熱裝置):
CH3CH2Br+H2O。有關數據和實驗裝置如(反應需要加熱,圖中省去了加熱裝置):
乙醇 | 溴乙烷 | 溴 | |
狀態 | 無色 液體 | 無色 液體 | 深紅棕色 液體 |
密度/g·cm-3 | 0.79 | 1.44 | 3.1 |
沸點/℃ | 78.5 | 38.4 | 59 |
(1)A中放入沸石的作用是__,B中進水口為__口(填“a”或“b”)。
(2)實驗中用滴液漏斗代替分液漏斗的優點為__。
(3)氫溴酸與濃硫酸混合加熱發生氧化還原反應的化學方程式__。
(4)給A加熱的目的是__,F接橡皮管導入稀NaOH溶液,其目的是吸收__和溴蒸氣,防止__。
(5)C中的導管E的末端須在水面以下,其原因是__。
(6)將C中的鎦出液轉入錐形并瓶中,連振蕩邊逐滴滴入濃H2SO41~2mL以除去水、乙醇等雜質,使溶液分層后用分液漏斗分去硫酸層;將經硫酸處理后的溴乙烷轉入蒸鎦燒瓶,水浴加熱蒸餾,收集到35~40℃的餾分約10.0g。
①分液漏斗在使用前必須__;
②從乙醇的角度考慮,本實驗所得溴乙烷的產率是__(精確到0.1%)。
【答案】防止暴沸 b 平衡壓強,使濃硫酸順利滴下 2HBr+H2SO4(濃)![]() SO2+Br2+2H2O 加快反應速率,蒸餾出溴乙烷 SO2 防止污染環境 冷卻并減少溴乙烷的揮發 檢漏 53.4%
SO2+Br2+2H2O 加快反應速率,蒸餾出溴乙烷 SO2 防止污染環境 冷卻并減少溴乙烷的揮發 檢漏 53.4%
【解析】
(1)液體加熱需要防止液體瀑沸,B為球形冷凝管,應采取逆流原理通入冷凝水,進行充分冷凝回流;
(2)滴液漏斗可以使漏斗的上方和下方的壓強相等,使濃硫酸順利流下;
(3)濃硫酸有強氧化性,氫溴酸與濃硫酸混合加熱可生成Br2和SO2;
(4)給A加熱可以加快反應速率蒸出溴乙烷;實驗中產生的二氧化硫、溴化氫、溴等可以用稀NaOH溶液吸收;
(5)通過E的末端插入水面以下冷卻減少溴乙烷的揮發;
(6)①帶有活塞或瓶塞的裝置使用前要檢查是否漏水;
②10mL乙醇的質量為0.79×10g=7.9g,其物質的量為0.172mol,所以理論制得溴乙烷的物質的量為0.172mol,其質量為18.75g,根據產率=![]() ×100%計算。
×100%計算。
(1)液體加熱加入沸石,可以防止液體瀑沸,B為球形冷凝管,應采取逆流原理通入冷凝水,進行充分冷凝回流,所以B中進水口為b;
(2)滴液漏斗可以使漏斗的上方和下方的壓強相等,使濃硫酸順利流下,而分液漏斗沒有這個功能;
(3)濃硫酸有強氧化性,氫溴酸與濃硫酸混合加熱可生成Br2和SO2,發生氧化還原反應的化學方程式為2HBr+H2SO4(濃)![]() SO2+Br2+2H2O;
SO2+Br2+2H2O;
(4)加熱的目的是加快反應速率,溫度高于38.4℃溴乙烷全部揮發蒸餾出來,實驗中產生的二氧化硫、溴化氫、溴等會污染空氣,所以可以用稀NaOH溶液吸收,防止污染環境;
(5)導管E的末端須在水面以下,通過冷卻得到溴乙烷,減少溴乙烷的揮發;
(6)①分液漏斗有上口塞子和下口有控制液體流量的活塞,在使用前需要檢查是否漏水;
②10mL乙醇的質量為0.79×10g=7.9g,其物質的量為0.172mol,所以理論制得溴乙烷的物質的量為0.172mol,其質量為18.75g,所以溴乙烷的產率=![]() ×100%≈53.4%。
×100%≈53.4%。


科目:高中化學 來源: 題型:
【題目】請根據表格中提供的甲、乙、丙、丁四種元素的相關信息完成下列問題:
元素 | 甲 | 乙 | 丙 | 丁 |
原子序數 | 11 | ③ | ||
元素符號 | ② | S | ||
原子結構示意圖 | ① |
| ||
元素周期表中的位置 | 第三周期 ⅢA族 | ④ |
(1)填寫表格中各序號所對應的空白:①_________________②__________________
③_________________④_________________。
(2)甲、乙、丙、丁四種元素中,原子半徑最大的是_______(填元素符號),丁元素的最高正價為____價(填化合價)。
(3)最高價氧化物對應水化物的堿性:甲_______________乙(填“>”或“<”),簡單氣態氫化物的穩定性:丙_______________丁(填“>”或“<”)。
(4)元素乙的最高價氧化物對應水化物,既能與元素甲的最高價氧化物對應水化物反應,又能中和過多的胃酸。
請分別寫出上述反應的離子方程式:_____________;______________。
(5)丁單質通入冷的消石灰中可制得漂白粉,寫出該反應的化學方程式:_____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在試管A中加入3mL乙醇,然后邊振蕩試管邊慢慢加入2mL濃硫酸和2mL乙酸,按下圖所示連接好裝置進行實驗,以制取乙酸乙酯。
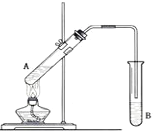
(1)試管B中盛放的溶液是_____________,其作用是:_____________
(2)反應的化學方程式是____________
(3)分離產物用的儀器是___________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物![]() (X)、
(X)、![]() (Y)、
(Y)、![]() (Z)的分子式均為C5H6。下列說法正確的是( )
(Z)的分子式均為C5H6。下列說法正確的是( )
A.X、Y、Z均能使酸性高錳酸鉀溶液褪色
B.Z的同分異構體只有X和Y兩種
C.Z的二氯代物只有兩種(不考慮立體異構)
D.Y分子中所有碳原子均處于同一平面
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】隨著石油資源的日益枯竭,天然氣的廾發利用越來越受到重視。CH4/CO2催化重整制備合成氣(CO和H2)是溫室氣體CO2和CH4資源化利用的重要途徑之一,并受了國內外研究人員的高度重視。回答下列問題:
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
CO(g)+3H2(g) △H1=+205.9 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CO2(g)+H2(g) △H2=-41.2 kJ·mol-1
CH4/CO2催化重整反應為CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H
2CO(g)+2H2(g) △H
該催化重整反應的△H=______kJ·mol-1。要縮短該反應達到平衡的時間并提高H2的產率可采取的措施為_____。
(2)向2L剛性密閉容器中充入2molCH4和2mol CO2進行催化重整反應,不同溫度下平衡體系中CH4和CO的體積分數(![]() )隨溫度變化如下表所示。
)隨溫度變化如下表所示。
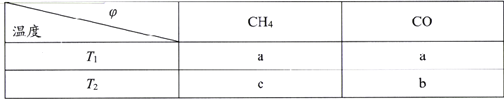
已知b>a>c,則T1______T2(填“>”“<”或“=”)。T1下該反應的平衡常數K=_______(mol2·L-2)
(3)實驗硏究表明,載體對催化劑性能起著極為重要的作用,在壓強0.03MPa,溫度750℃條件下,載體對鎳基催化劑性能的影響相關數據如下表:
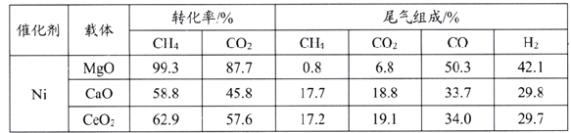
由上表判斷,應選擇載體為_______(填化學式),理由是________。
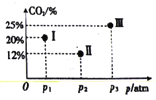
(4)現有溫度相同的I、Ⅱ、Ⅲ三個恒壓密閉容器,均充入2mol CH4(g)和2 molCO2(g)進行反應,三個容器的反應壓強分別為p1atm、p2atm、p3atm,在其他條件相同的情況下,反應均進行到tmin時,CO2的體積分數如圖所示,此時I、Ⅱ、Ⅲ個容器中一定處于化學平衡狀態的是_______。
(5)利用合成氣為原料合成甲醇,其反應為CO(g)+2H2(g)![]() CH3OH(g),在一定溫度下查得該反應的相關數據如下表所示:
CH3OH(g),在一定溫度下查得該反應的相關數據如下表所示:
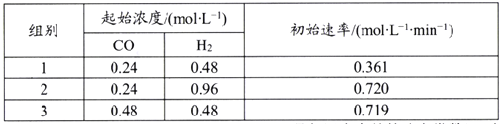
該反應速率的通式為ν正=k正cm(CO)·cn(H2)(k正是與溫度有關的速率常數)。由表中數據可確定反應速率的通式中n=____(取正整數)。若該溫度下平衡時組別1的產率為25%,則組別1平衡時的v正=______(保留1位小數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氟代硼酸鉀(KBe2BO3F2)是激光器的核心材料,我國化學家在此領域的研究走在了世界的最前列。回答下列問題:
(1)氟代硼酸鉀中非金屬元素原子的電負性大小順序是__。基態K+的電子排布式為__。
(2)NaBH4是有機合成中常用的還原劑,其中的陰離子空間構型是__,中心原子的雜化方式為__。NaBH4中存在__(填標號)。
a.離子鍵 b.氫鍵 c.σ鍵 d.π鍵
(3)BeCl2中的化學鍵具有明顯的共價性,蒸汽狀態下以雙聚分子存在的BeCl2的結構式為__,其中Be的配位數為__。
(4)第三周期元素氟化物的熔點如下表:
化合物 | NaF | MgF2 | AlF3 | SiF4 | PF5 | SF6 |
熔點/℃ | 993 | 1261 | 1291 | -90 | -83 | -50.5 |
解釋表中氟化物熔點變化的原因:___。
(5)CaF2的一種晶胞如圖所示。Ca2+占據F-形成的空隙,若r(F-)=xpm,r(Ca2+)=ypm,設阿伏加德羅常數的值為NA,則CaF2的密度ρ=__g·cm-3(列出計算表達式)。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示的電解裝置中,A池盛有200mL飽和KCl溶液,B池盛有200ml飽和CuSO4溶液,四個電極都用惰性材料制成,通電一段時間后,B池中陰極增重0.64g,求:
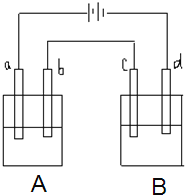
(1)寫出A、B兩池中陽極電極反應式________。
(2)計算標準狀況下氣體各為多少升?_________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇是一種可再生能源,由CO2制備甲醇的過程可能涉及的反應如下:反應Ⅰ:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.58kJ·mol-1
反應Ⅱ:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反應Ⅲ:CO(g)+2H2(g)![]() CH3OH(g) △H3=-90.77kJ·mol-1
CH3OH(g) △H3=-90.77kJ·mol-1
回答下列問題:
(1)反應Ⅱ的△H2=______________。
(2)反應Ⅲ能夠自發進行的條件是__________ (填“較低溫度”、“ 較高溫度”或“任何溫度”)
(3)恒溫,恒容密閉容器中,對于反應Ⅰ,下列說法中能說明該反應達到化學平衡狀態的是________。
A.混合氣體的密度不再變化
B.混合氣體的平均相對分子質量不再變化
C.CO2、H2、CH3OH、H2O的物質的量之比為1:3:1:1
D.甲醇的百分含量不再變化
(4)對于反應Ⅰ,不同溫度對CO2的轉化率及催化劑的效率影響如圖所示,下列有關說法不正確的是__________。

A.其他條件不變,若不使用催化劑,則250℃時CO2的平衡轉化率可能位于M1
B.溫度低于250℃時,隨溫度升高甲醇的產率增大
C.M點時平衡常數比N點時平衡常數大
D.實際反應應盡可能在較低的溫度下進行,以提高CO2的轉化率
(5)若在1L密閉容器中充入3molH2和1molCO2發生反應Ⅰ,250℃時反應的平衡常數K=______;若要進一步提高甲醇體積分數。可采取的措施有_________________。
(6)下圖是電解Na2CO3溶液的裝置圖。

陰極的電極反應式為________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】工業上可用軟錳礦(主要成分是MnO2)和黃鐵礦(主要成分是FeS2)為主要原料制備高性能磁性材料碳酸錳(MnCO3)。其工藝流程如下:( )
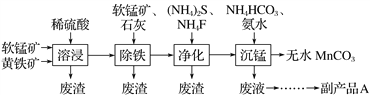
已知:凈化工序的目的是除去溶液中的Ca2+、Cu2+等雜質(CaF2難溶)。
下列說法不正確的是
A. 研磨礦石、適當升高溫度均可提高溶浸工序中原料的浸出率
B. 除鐵工序中,在加入石灰調節溶液的pH前,加入適量的軟錳礦,發生的反應為MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O
C. 副產品A的化學式(NH4)2S
D. 從沉錳工序中得到純凈MnCO3的操作方法是過濾、洗滌、干燥
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com